近日,塔夫茨大學化學與生物工程系的NikhilU. Nair教授團隊在ACS Catalysis上發(fā)表了題為“In-Depth
Sequence?Function Characterization Reveals Multiple Pathways to Enhance
Enzymatic Activity”的文章���。
深度突變掃描 (Deep mutational scanning,
DMS)已成為評估序列-功能關系、識別功能熱點、并加速和/或擴大工程活動的強大方法�����。它可以提供全面的序列-功能關系圖以探索蛋白質適應度景觀����、發(fā)現(xiàn)新的功能相關位點以及確定蛋白質工程的有益突變組合���。本文作者開發(fā)了一種工作流程來設計苯丙氨酸解氨酶(PAL),并進一步評估特定突變?nèi)绾慰朔呋^程中限制活性的不同步驟���,整體流程如圖1所示����。
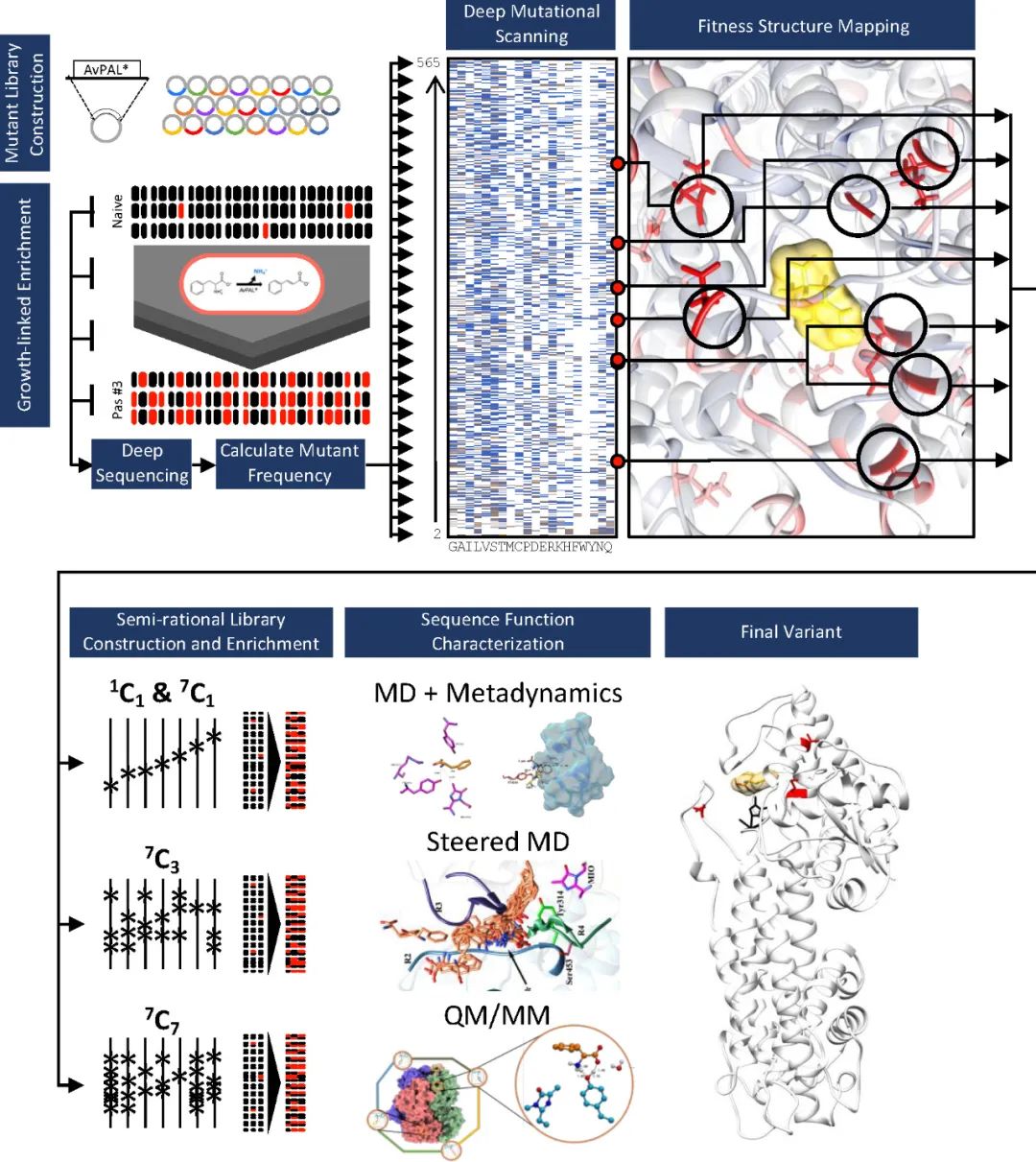
圖1 工作流程
苯丙氨酸解氨酶(PAL)可將L-苯丙氨酸(Phe)脫氨基生成反式肉桂酸(tCA)和銨 (NH4+)����,含有4-亞甲基咪唑-5-一(MIO)加合物。PAL可用于天然產(chǎn)物和精細化學品的合成以及苯丙酮尿癥的治療����。雖然有大量關于PAL的結構和催化機制的文獻解釋了底物結合口袋中的殘基如何促進底物特異性和轉換數(shù),但是對如何通過突變不與底物直接接觸的殘基來提高酶催化性能的了解很少。
該團隊此前開發(fā)了一種生長偶聯(lián)富集技術�,用于在大腸桿菌中快速篩選AvPAL的高活性變體。原理是高活性AvPAL變體可以更快地催化Phe脫氨生成NH4+���,從而促進大腸桿菌的生長��?��;诖思夹g,作者對AvPAL進行隨機突變獲得了Naive文庫���,并傳代富集了3次�。然后使用高通量篩選方法對AvPAL進行DMS���,獲得其詳細序列-功能圖譜(圖2)����。在第3代的突變體文庫中���,218�、222和453位點的突變高度富集(圖2a)�����。Naive文庫每個基因包含大約2-4個氨基酸突變,突變分布廣泛(565個殘基)����,每個殘基平均有5.6個替換。而第3代中只有222個位置有突變�,且平均只有0.6個突變(圖2b)。負適應度(灰色)指的是在傳代過程中出現(xiàn)頻率下降的突變�����,而適應度最高的“熱點”T102�����、G218����、M222L�、I268、D306�、G360、N453被用于后續(xù)研究(圖2c)�。通過對比�����,作者發(fā)現(xiàn)適應度得分與酶的催化活性具有很高的相關性����。
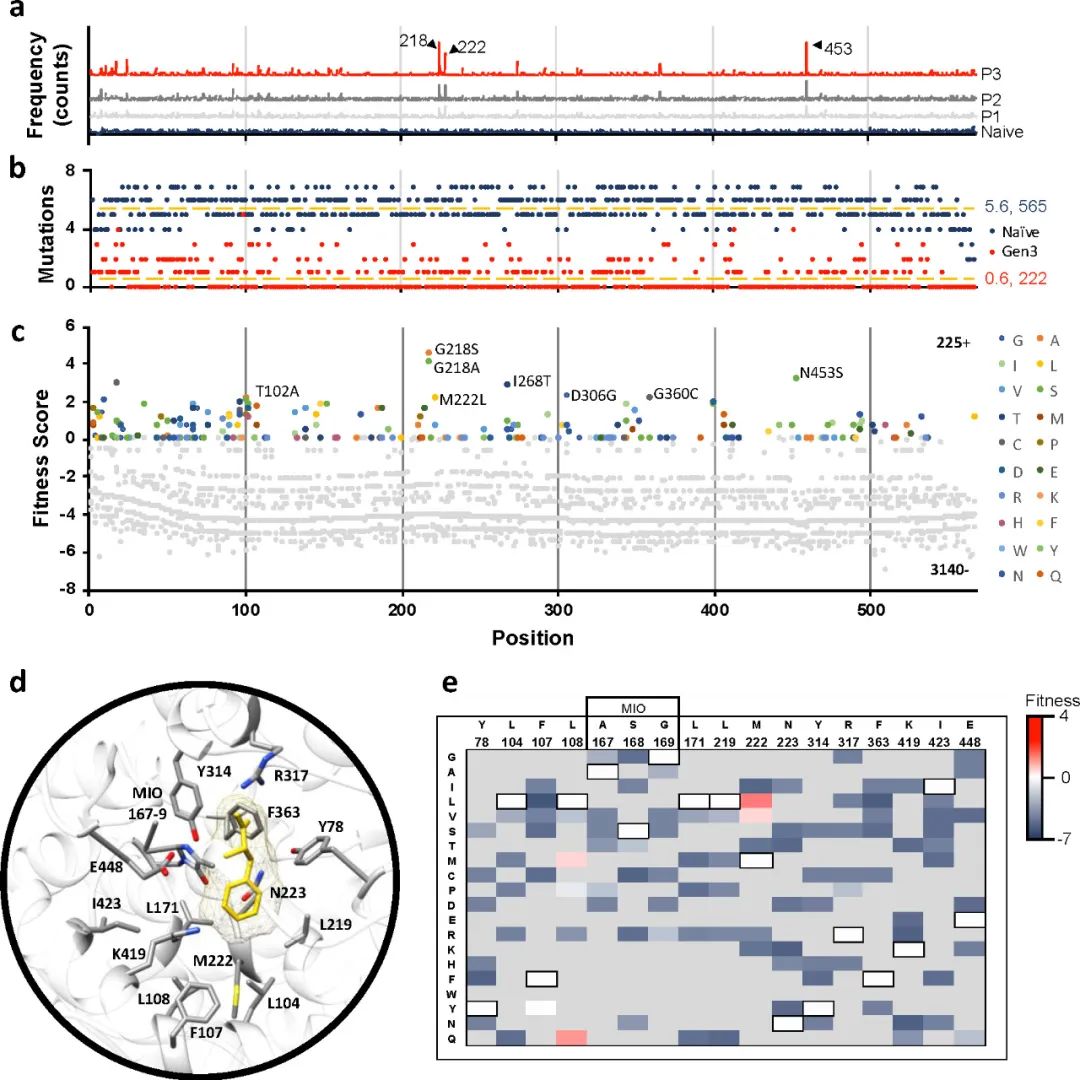
圖2 AvPAL的DMS結果
作者計算了3個傳代突變庫相對于Naive庫的適應度梯度�����,并將適應度映射到AvPAL蛋白結構上(圖3)���。AvPAL是同源四聚體���,包含四個活性位點,每個活性位點由來自三個不同單體和一個MIO基團的殘基組成����。多數(shù)有益突變距離同一鏈的活性中心較遠而靠近鄰近鏈的活性中心。有趣的是��,前四個突變(G218S/A��、M222L和N453S)作為單位點突變的豐度最高����,而三點組合突變則完全不存在���,這表明有必要進一步組合研究這些熱點。
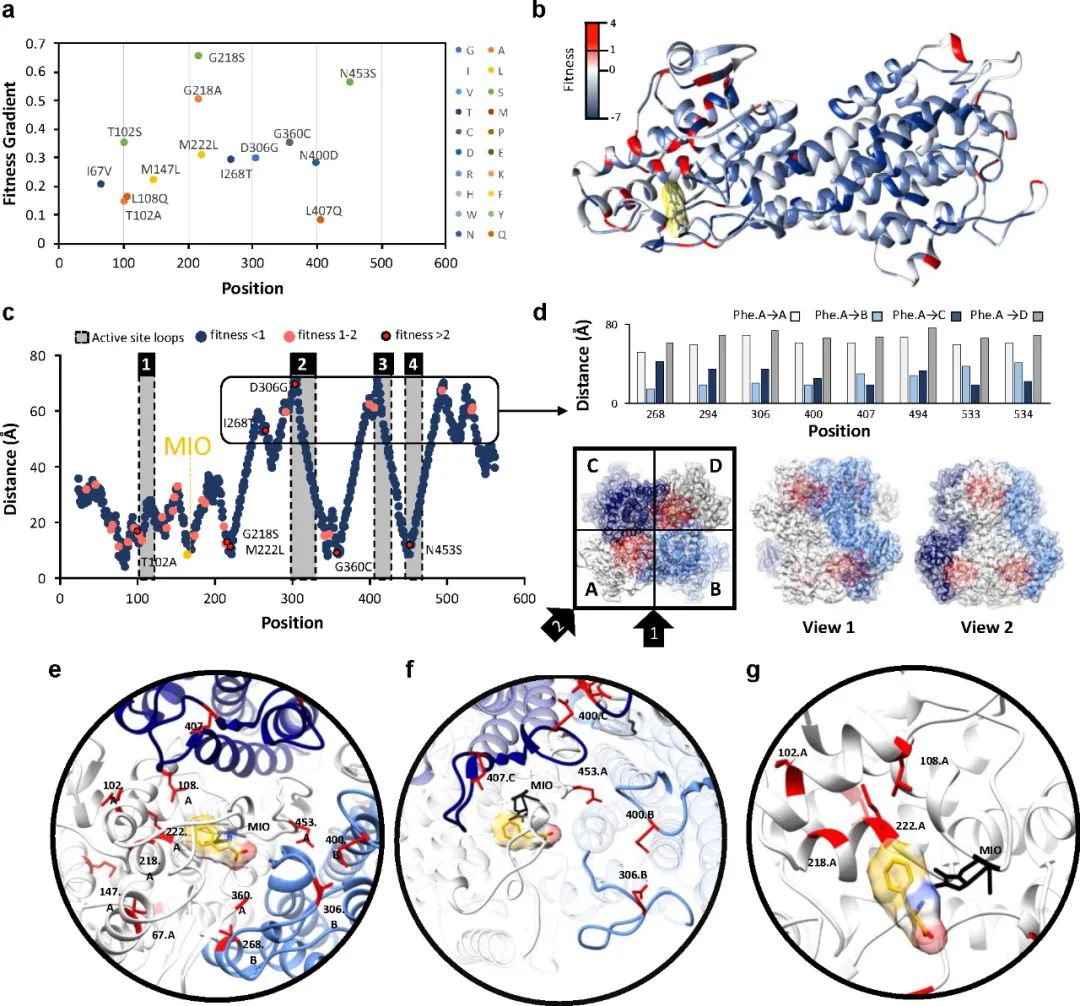
圖3 識別和定位最合適的位點
作者利用7個熱點分別構建了包含一個(7C1 7選1)���,三個(7C3 7選3)��,七個(7C7 7選7)位點突變的組合突變庫�����。7C1文庫中所有位點都有比野生型更適合的替換(圖 4a)�����,而7C3和7C7文庫中較少的突變具有積極的適應度得分(圖 4b 和 c)。這表明雖然許多突變單獨有助于提高適應度���,但大多數(shù)突變并不協(xié)同作用����。對與AvPAL同源性最高的100個蛋白質進行序列比較�����,發(fā)現(xiàn)對于218、222�、306和360位點,天然序列中完全涵蓋了研究中發(fā)現(xiàn)的最適合的變體���。而對于102���、268和453位點,發(fā)現(xiàn)了僅通過序列比對無法預測的新突變(圖4d)��。其中�,T102E-M222L和T102R-M222L-D306G的kcat分別顯示出2.4倍和2.25倍的改進。
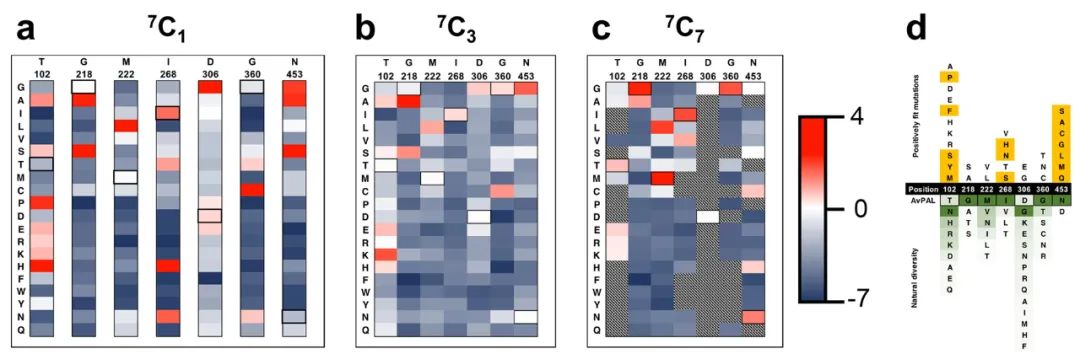
圖4 飽和突變庫的表征
為了揭示酶活增加的機制��,作者對各突變體進行MD模擬分析����。在MD模擬期間底物和催化殘基之間的緊密接近表明穩(wěn)定的E-S復合物和近攻擊構象的形成。通過測量變體的底物氨基氮(Phe(N))與MIO亞甲基碳(MIO(Cβ2))和相鄰鏈上314位酪氨酸羥基氧(Y314(O))之間的距離���,以及對比蛋白質主鏈原子的均方根波動(RMSF)����,發(fā)現(xiàn)對于五種高活性變體中的四種(M222L、G218S�����、T012E-M222L和T102R-M222L-D306G)���,底物更容易接近催化位點形成穩(wěn)定的近攻擊構象(圖5)���。然而,N453S與親本相比基本沒有變化����,這表明其作用方式可能不涉及直接調(diào)節(jié)底物和催化殘基之間的相互作用。
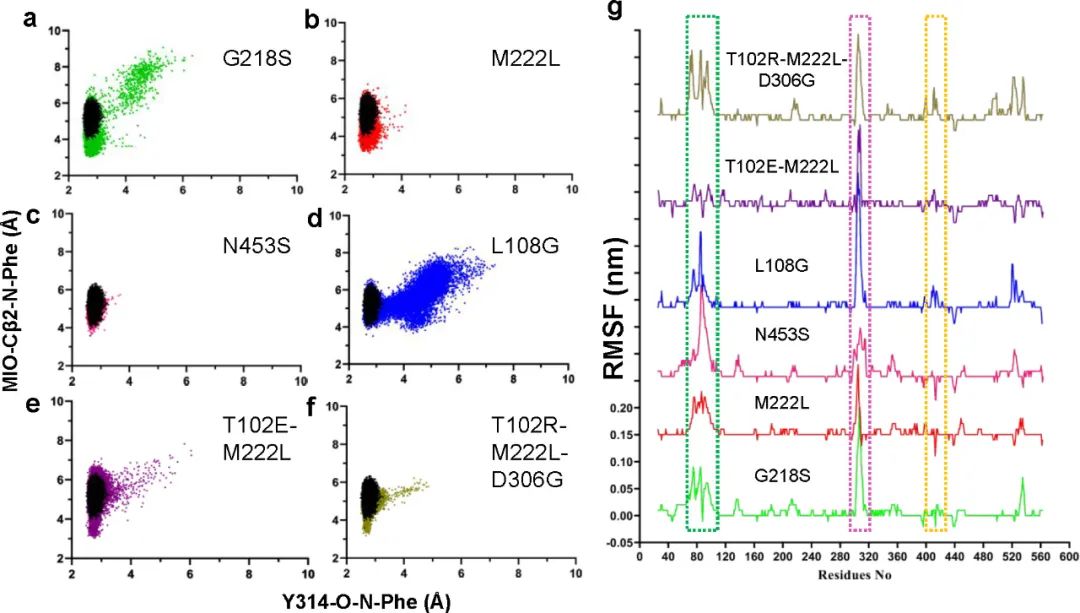
圖5 MD結果分析
由于N453S位于活性位點外圍����,作者認為它可能會影響底物Phe的結合過程。因此�����,對AvPAL和突變體進行導向分子動力學(SMD)以研究Phe從活性位點離開蛋白質期間的能量變化與涉及到的相關殘基����。平均力勢(PMF)圖顯示N453S有兩個最小值,而在AvPAL中沒有觀察到(圖6a)���。從傘形采樣中提取Phe的構象變化���,并映射到AvPAL和N453S的結構上(圖 6b和c)。對于AvPAL�,通向活性位點的路徑很窄,導致進入受限且在能量上不利���。N453S的路徑更寬����,能量更有利����,底物呈現(xiàn)良好的構象。
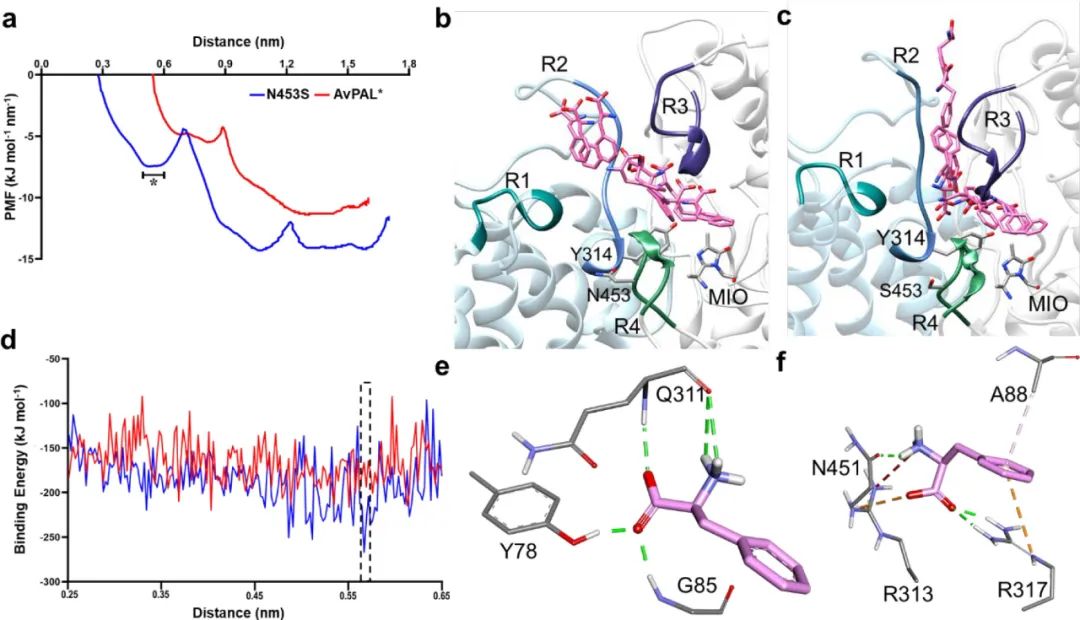
圖6 AvPAL����、N453S的SMD和傘形采樣結果
接著作者假設N453S與其他突變體結合可能會進一步提高酶活性,并構建了M222L��、L4P-G218S、T102E-M222L和T102R-M222L-D306G的N453S突變體�。通過評估純酶的動力學(圖7a-e)和Phe到tCA的全細胞轉化(圖7f),發(fā)現(xiàn)添加N453S的變體都顯示出與親本相似的動力學參數(shù)�,且vmax都有所降低,但T102E-M222L-N453S對Phe的轉化率卻提高了6倍以上�。作者假設Phe可能更容易從活性位點取代 tCA從而減少了產(chǎn)物抑制,并隨后通過添加產(chǎn)物的方式驗證了該假設����。
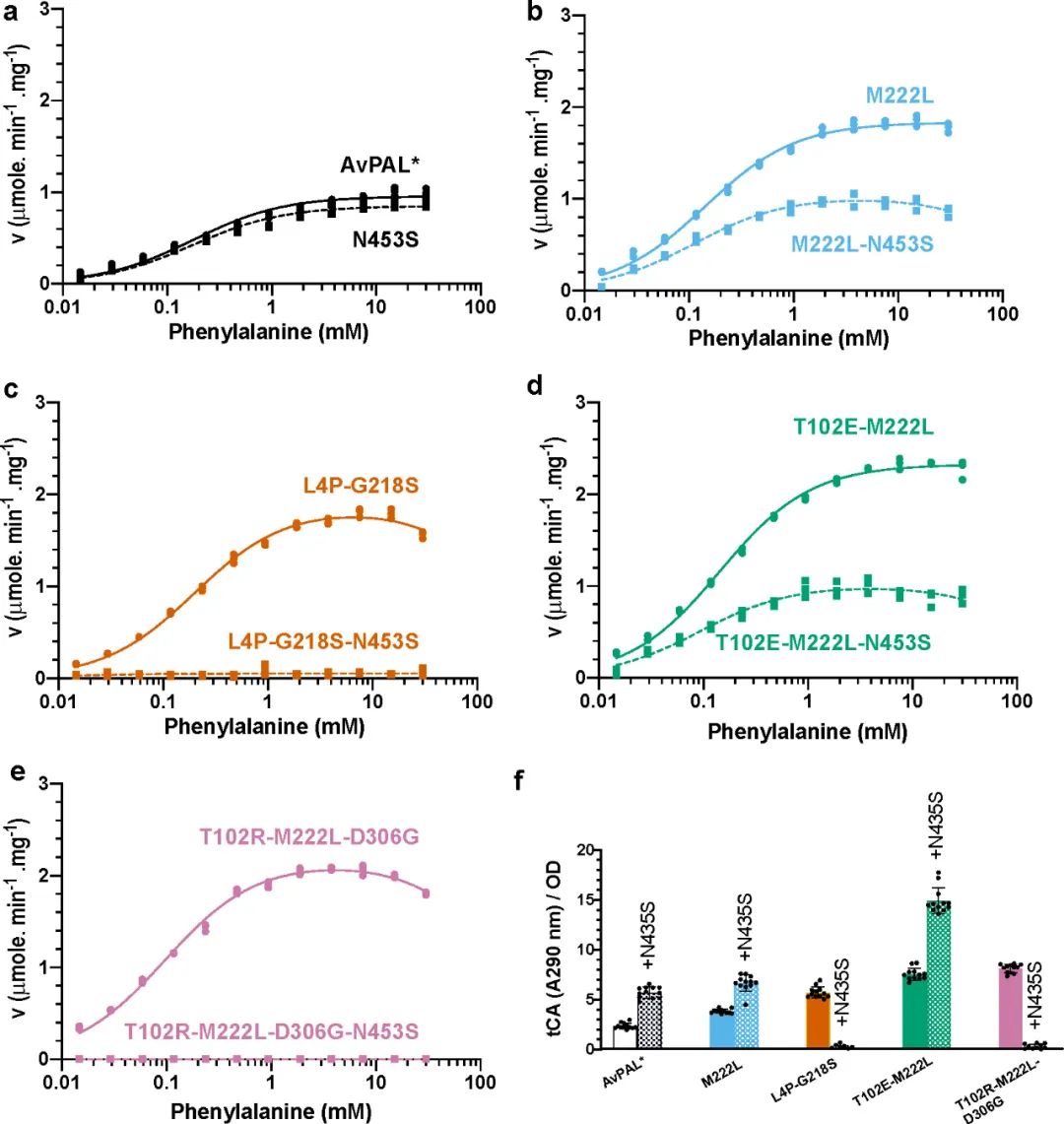
圖7 N453S的動力學表征和全細胞活性
基于此前對PAL反應機制的研究,作者通過QM/MM模擬提出了AvPAL的反應機理(圖8a-c)��,并計算出了總相對自由能圖(圖8d)����。對比TS1和IS1的能量可以看出L108G
< AvPAL< M222L < G218S<T102EM222L <
T102R-M222L-D306G,符合實驗結果�。
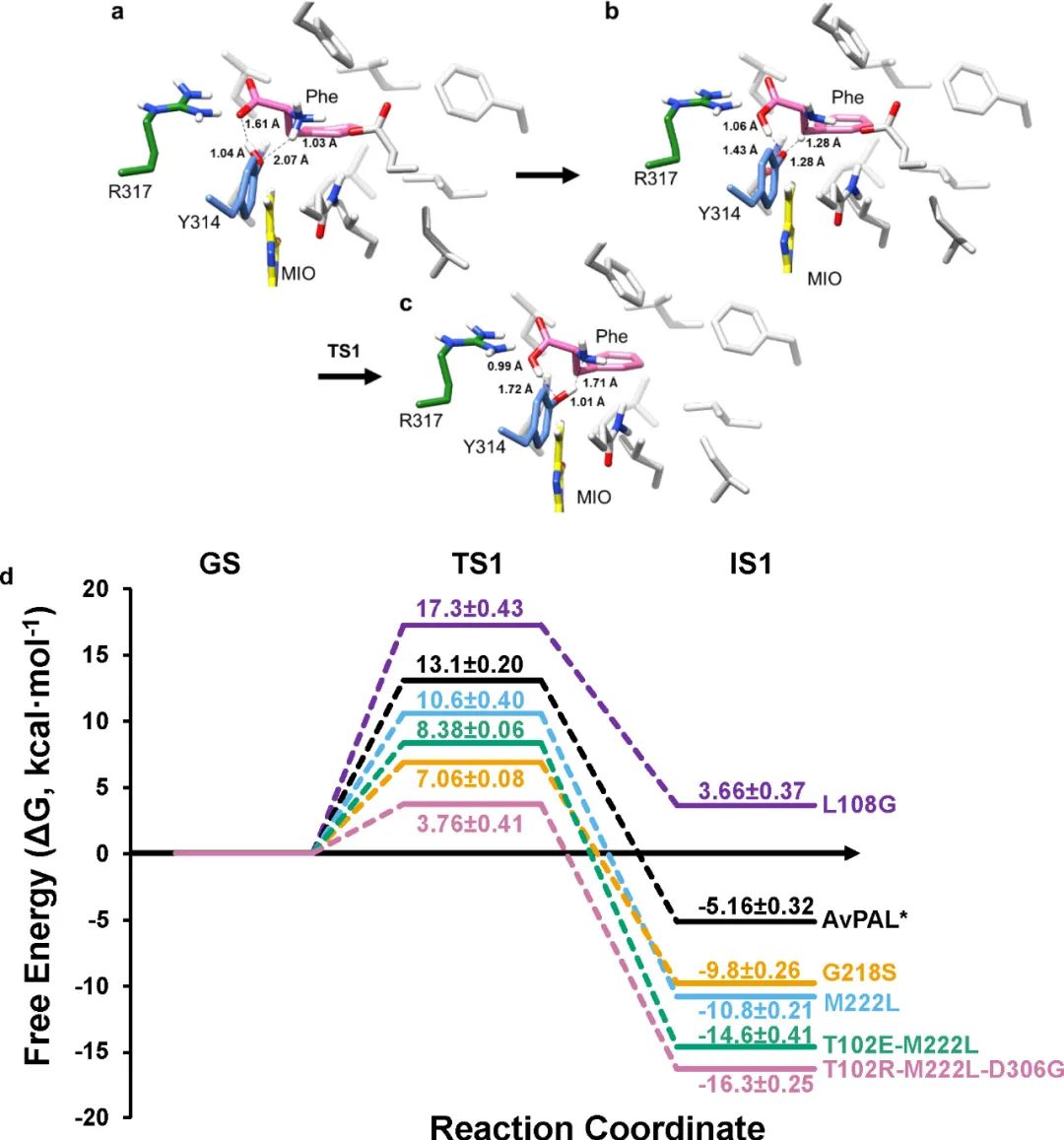
圖8 對AvPAL的QM/MM研究
總之,作者報告了DMS可以指導進一步的蛋白質工程����,同時也為闡明催化循環(huán)局限性的基礎研究提供了起點。對含有MIO的酶AvPAL提供了最廣泛的序列功能分析�����,并創(chuàng)建高活性的變體����。通過計算研究(QM/MM、MD 和SMD+QM/MM)��,揭示了突變增強酶活性的機制�,并獲得更優(yōu)良的突變體(T102R-M222L-N453S)。這不僅顯著推進了PAL的酶學和工程學��,而且還展示了使用DMS指導基礎和應用酶學的能力�����。
輝駿實力











 實驗熱線:4006991663
實驗熱線:4006991663