腫瘤細(xì)胞衍生的細(xì)胞外囊泡(EV)正在作為循環(huán)生物標(biāo)志物進(jìn)行探索���,但尚不清楚批量測量是否可以進(jìn)行早期癌癥檢測����。來自哈佛醫(yī)學(xué)院的Ralph Weissleder教授團(tuán)隊在Science Advances雜志發(fā)表文章,研究發(fā)現(xiàn)單EV分析(sEVA)技術(shù)可提高癌癥診斷的準(zhǔn)確性。

胰腺導(dǎo)管腺癌(PDAC)目前是癌癥死亡的重要原因之一���。治愈胰腺癌的唯一方法是在它仍然在局部時通過手術(shù)切除它��。在目前的治療模式下���,只有20%的患者可手術(shù),而40%的患者會出現(xiàn)局部但手術(shù)無法切除���,而其余的40%的患者會出現(xiàn)轉(zhuǎn)移��。盡管有最先進(jìn)的計算機(jī)斷層掃描(CT)����、磁共振成像(MRI)和超聲內(nèi)鏡對“影像學(xué)發(fā)現(xiàn)的局部疾病”和接受手術(shù)的患者進(jìn)行手術(shù)�,但切緣的病理陽性率為40%至70%,并且胰周淋巴結(jié)病變病理陽性率為60%~80%��。如果我們要治愈更多的胰腺癌患者�,就需要新的診斷工具來識別患有臨床前和真正局部疾病的患者,并探索新的治療方法以允許更多的R0/N0切除�����。
高分辨率、對比增強(qiáng)CT和MRI成像是常做的檢查�����,但它們在檢測微小疾病方面的敏感性通常受到限制���,特別是在新輔助和術(shù)后環(huán)境中�。技術(shù)進(jìn)步繼續(xù)快速提高檢測血液樣本中循環(huán)生物標(biāo)志物的能力�。這些“液體活檢”標(biāo)志物包括突變或甲基化無細(xì)胞DNA(cfDNA)�����、腫瘤相關(guān)細(xì)胞外囊泡(EV)�、循環(huán)腫瘤細(xì)胞和代謝參數(shù)(例如����,糖尿病和肌肉萎縮)。盡管EV�、cfDNA和代謝標(biāo)志物已經(jīng)顯示出用于PDAC診斷的前景,但它們目前的檢測靈敏度需要進(jìn)一步改進(jìn)才能在臨床上有用���。特別是在疾病早期����,較低的診斷準(zhǔn)確性可能是由于PDAC的大量基質(zhì)成分、與無腫瘤胰腺炎無法區(qū)分的胰腺炎局灶區(qū)域共存以及早期循環(huán)生物標(biāo)志物數(shù)量少�����。
研究人員已經(jīng)開發(fā)了許多分析EV的方法�����。許多早期技術(shù)依賴于批量測量�����,單次測量需要102到106個EV���。雖然單EV方法[用多熒光���、單粒子干涉反射熒光成像、納米粒子跟蹤分析�、微流體電阻脈沖傳感和納米流式細(xì)胞術(shù)進(jìn)行單EV分析(sEVA)]正在積極開發(fā)中,但它們測量不同的參數(shù)(通常是大小而不是比分子生物標(biāo)志物)���。不管具體的物理測量如何���,下一個問題是要分析哪種分子生物標(biāo)志物���。雖然研究仍在進(jìn)行中,但很明顯�����,許多描述的生物標(biāo)志物在更大的臨床驗(yàn)證隊列中都失敗了��。因此出現(xiàn)的一個關(guān)鍵問題是��,這種失敗是否是由于選擇了給定的分子生物標(biāo)志物��、PDAC的極端異質(zhì)性��,或者無法準(zhǔn)確檢測正常EV群體中極少量的生物標(biāo)志物陽性EV�。
作者認(rèn)為��,解決當(dāng)前問題的一種方法是進(jìn)行sEVA�����,因?yàn)榕糠椒赡軣o法在宿主EV的背景下識別少量起源于腫瘤的EV(例如在微觀癌癥中發(fā)現(xiàn)的那些)�����。進(jìn)一步假設(shè)突變的癌蛋白(例如,KRASmut)或腫瘤抑制基因(例如�,P53mut)可以在單個EV中檢測到,而癌細(xì)胞中發(fā)生的相同突變是腫瘤EV脫落增加的原因���。檢測這些突變蛋白質(zhì)的選擇也受到它們在PDAC發(fā)展級聯(lián)中的早期出現(xiàn)的驅(qū)動�。最后�,作者推斷可以通過對幾種生物標(biāo)志物進(jìn)行多重測量來提高檢測效率。在這些范例的基礎(chǔ)上���,開發(fā)并驗(yàn)證了一種強(qiáng)大的sEVA技術(shù)��,該技術(shù)允許在單個EV中進(jìn)行多重蛋白質(zhì)測量�。sEVA技術(shù)可解答如下問題:(i)EV中假定的癌細(xì)胞相關(guān)蛋白的固有異質(zhì)性是什么���,(ii)單個EV中突變的腫瘤/腫瘤抑制蛋白的頻率是多少���,以及(iii)單個EV上兩種或多種癌癥相關(guān)蛋白的表達(dá)水平是多少?通過非重疊標(biāo)記“覆蓋”更多腫瘤衍生的EV(tEV)或獲得“高度特異性”的EV鑒定(如KRASmut和P53mut)是改善臨床PDAC診斷的可靠選擇�����。
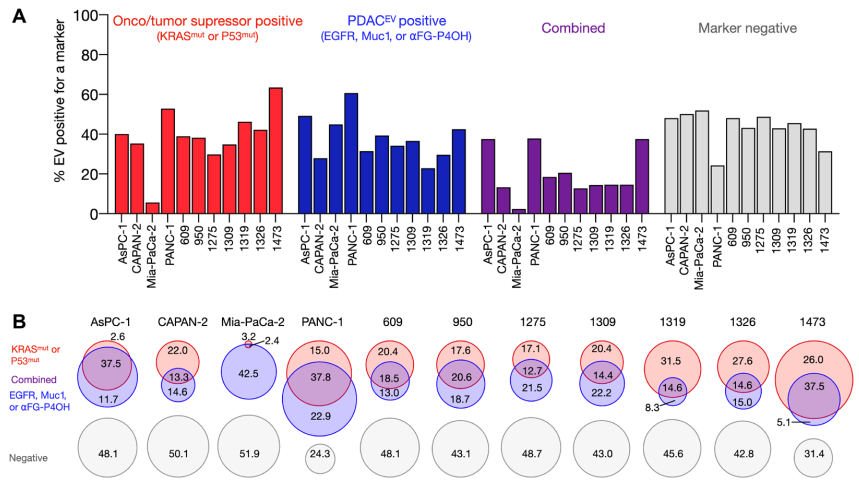
多個PDAC細(xì)胞系衍生EV的sEVA分析
使用胰腺癌(PDAC),作者分析了11個細(xì)胞系中推定的癌癥標(biāo)志物的組成�����。在KRASmut和/或P53mut蛋白陽性的親代PDAC細(xì)胞中�,只有約40%的EV也是陽性的。
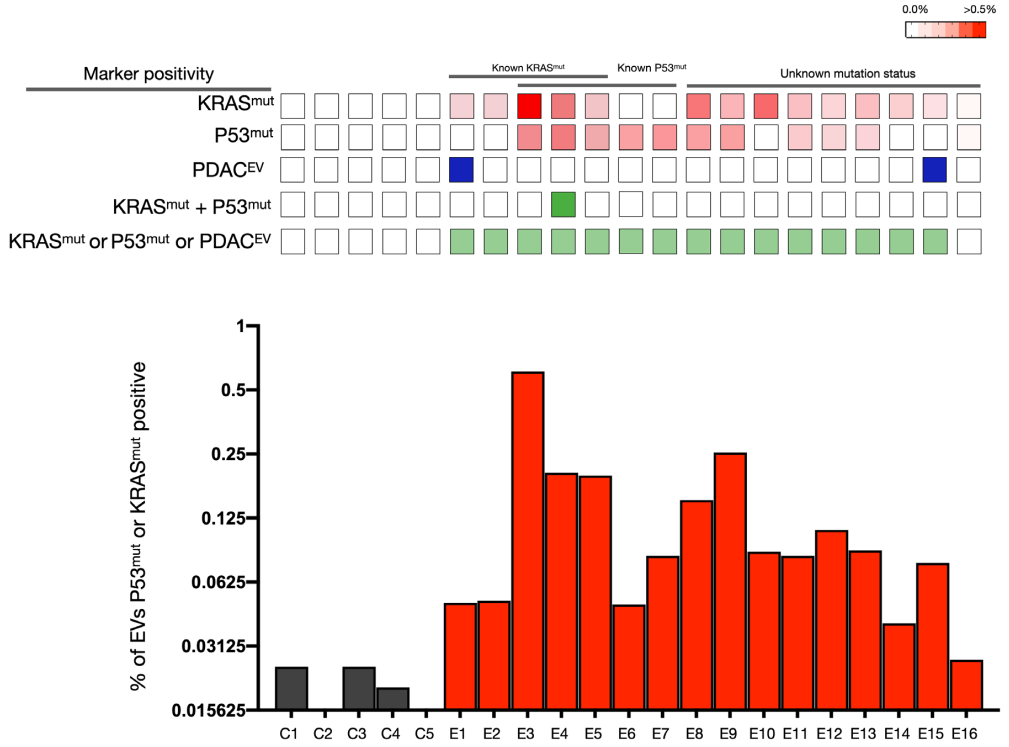
臨床1期PDAC病例的sEVA分析結(jié)果
在一項涉及16名經(jīng)手術(shù)證實(shí)為1期PDAC患者的盲法研究中�����,可檢測到KRASmut和P53mut蛋白的水平要低得多����,通常在<0.1%的囊泡中(即,患者樣本中陽性囊泡占比通常<0.1%)��。16名患者中有15名可通過新的sEVA方法檢測到這些囊泡�����。
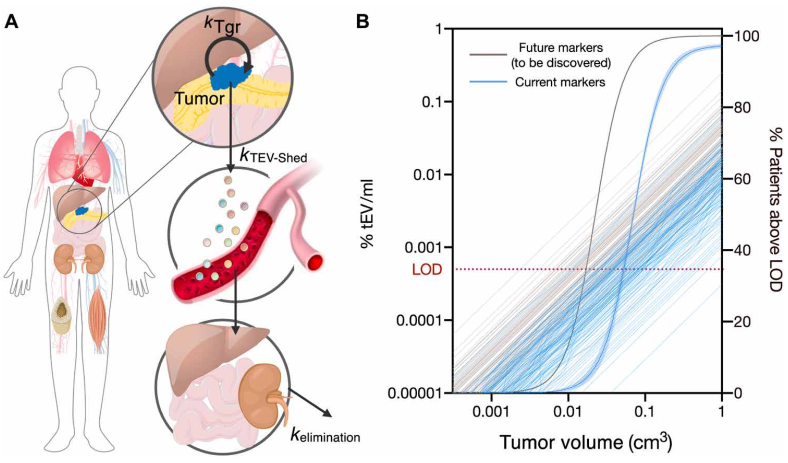
使用血漿sEVA對PDAC癌癥檢測進(jìn)行建模
使用建模方法�����,作者估計基于單EV分析(sEVA)技術(shù)的PDAC檢測限約為0.1-cm3腫瘤體積�,優(yōu)于臨床成像能力。這些發(fā)現(xiàn)確立了sEVA用于早期癌癥檢測的潛力�����。
參考文獻(xiàn):
FergusonS, Yang KS, Zelga P, Liss AS, Carlson JCT, Del Castillo CF, Weissleder R. Single-EVanalysis (sEVA) of mutated proteins allows detection of stage 1 pancreaticcancer. Sci Adv. 2022 Apr 22;8(16):eabm3453. doi:10.1126/sciadv.abm3453. Epub 2022 Apr 22. PMID: 35452280.
分子細(xì)胞生物學(xué)實(shí)驗(yàn)
輝駿實(shí)力


 實(shí)驗(yàn)熱線:4006991663
實(shí)驗(yàn)熱線:4006991663