中文標(biāo)題:FEN1促進(jìn)非小細(xì)胞肺癌腫瘤進(jìn)展并增強(qiáng)順鉑耐藥性
發(fā)表期刊:Molecular Oncology
影響因子:5.314
發(fā)表時(shí)間:2017年2月
合作單位:南京師范大學(xué)生命科學(xué)學(xué)院
運(yùn)用技術(shù):慢病毒包裝(由輝駿生物提供技術(shù)支持)
● 研究背景
肺癌是全球男性和女性癌癥相關(guān)死亡的主要原因,非小細(xì)胞肺癌(NSCLC)約占肺癌病例的85%�。如今在臨床治療中,大多數(shù)抗癌劑通過干擾DNA復(fù)制或誘導(dǎo)DNA損傷的方式來殺死細(xì)胞��,進(jìn)而導(dǎo)致細(xì)胞凋亡�����。在這些抗癌藥物中��,順鉑代表了癌癥臨床治療史上一個(gè)成功的里程碑�。然而�,由于癌細(xì)胞中高效的DNA復(fù)制和修復(fù)系統(tǒng),順鉑的療效并不充分��,耐藥機(jī)制也有待于進(jìn)一步研究�。
以往的報(bào)道表明,癌癥對(duì)DNA損傷誘導(dǎo)劑的耐藥性與癌細(xì)胞中DNA修復(fù)酶的表達(dá)升高有關(guān)����。DNA翻蓋內(nèi)切酶1(FEN1)是DNA修復(fù)途徑中的關(guān)鍵分子,鑒于順鉑誘導(dǎo)的DNA加合物鏈內(nèi)交聯(lián)主要由NER修復(fù)�����,我們推測(cè)抑制FEN1表達(dá)或抑制FEN1活性可能增強(qiáng)順鉑的治療效果���。鑒于FEN1在DNA復(fù)制中的作用�����,推測(cè)FEN1可能是肺癌細(xì)胞增殖所必需的�����。FEN1參與了NER和其他DNA修復(fù)途徑�,說明靶向FEN1可能是克服肺癌對(duì)順鉑耐藥性的潛在途徑���。FEN1抑制劑或可單獨(dú)作為阻斷癌細(xì)胞增殖的藥物���,或者與DNA損傷誘導(dǎo)劑聯(lián)合使用,以提高治療效果����。
● 研究結(jié)果
1. FEN1在肺癌細(xì)胞中上調(diào)并與預(yù)后不良相關(guān)
作為DNA復(fù)制的重要參與者,F(xiàn)EN1可能在癌癥組織中上調(diào)表達(dá)��。研究者通過數(shù)據(jù)庫(kù)比較了癌組織和正常組織中FEN1的表達(dá)水平��,結(jié)果表明����,肺癌組織中FEN1 mRNA的表達(dá)水平顯著高于正常組織(圖1A)����。研究者進(jìn)一步通過免疫組織化學(xué)(IHC)分析比較了正常組織和肺癌樣本中FEN1蛋白的表達(dá)水平�,證實(shí)了這一觀察結(jié)果(圖1B)。在正常組織中���,F(xiàn)EN1評(píng)分低于100分的患者占85%�����,這一比例明顯低于癌組織���。相反,癌組織中FEN1評(píng)分在200分以上的患者比例明顯高于正常組織���。數(shù)據(jù)庫(kù)數(shù)據(jù)分析結(jié)果表明�,肺癌的惡性程度隨著FEN1表達(dá)水平的增加而升高(圖1D)�,這說明肺癌的惡性程度與FEN1的過度表達(dá)有關(guān)。相應(yīng)地�����,F(xiàn)EN1水平高的患者總體生存時(shí)間明顯短于FEN1水平低的患者(圖1E)��。這些結(jié)果提示FEN1在肺癌中表達(dá)上調(diào)����,與腫瘤惡性程度和預(yù)后不良有關(guān)。
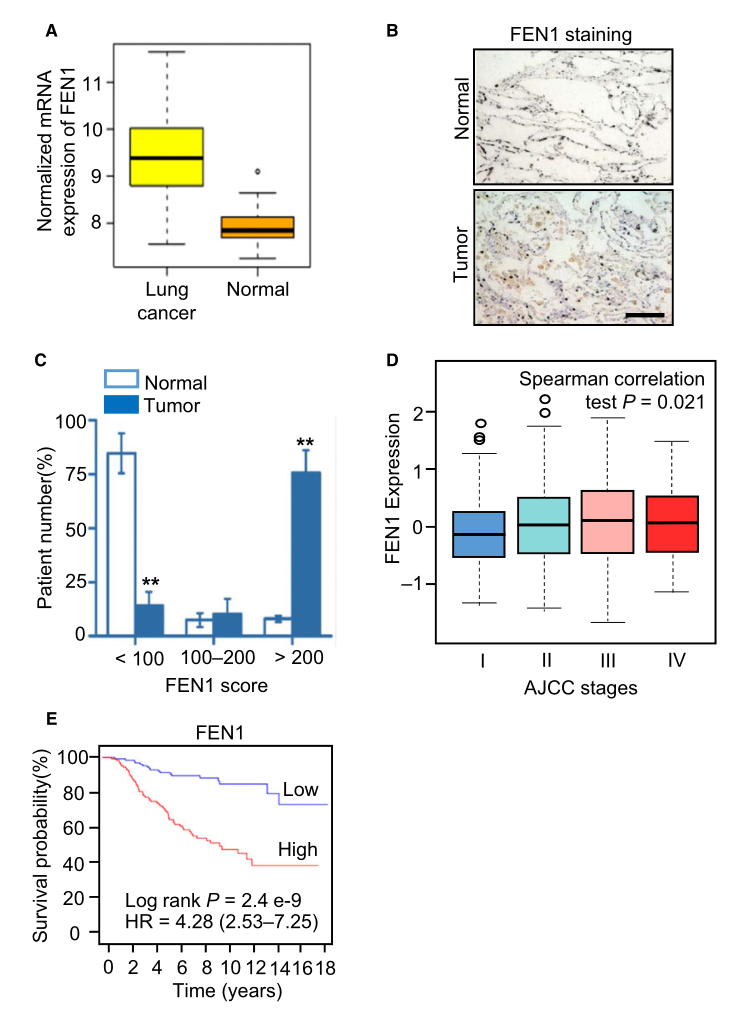
圖1
2. FEN1促進(jìn)腫瘤的體內(nèi)外進(jìn)展
本研究選擇A549細(xì)胞作為非小細(xì)胞肺癌藥物代謝研究的體外模型�����。上述數(shù)據(jù)已經(jīng)表明FEN1的過度表達(dá)與癌癥有關(guān)��,但FEN1的高表達(dá)是否會(huì)影響腫瘤進(jìn)展尚不清楚����。研究者比較了FEN1被siRNA下調(diào)的A549細(xì)胞的增殖率(圖2A)和FEN1異位過表達(dá)的A549細(xì)胞的增殖率(圖2B)。結(jié)果表明�,F(xiàn)EN1的下調(diào)抑制了細(xì)胞生長(zhǎng)(圖2C),而FEN1的過表達(dá)促進(jìn)了細(xì)胞生長(zhǎng)(圖2D)����。集落形成實(shí)驗(yàn)表明,過表達(dá)FEN1誘導(dǎo)了A549細(xì)胞的集落形成(圖2E-F)���,而內(nèi)源性FEN1的下調(diào)則降低了A549細(xì)胞的集落形成效率(圖2G)�����。此外����,流式細(xì)胞分析顯示,與對(duì)照細(xì)胞相比�����,F(xiàn)EN1基因敲除導(dǎo)致S期和G2/M期比例降低����,G1期比例增加。將異位FEN1過表達(dá)的細(xì)胞移植到裸鼠皮下后�,其腫瘤體積明顯大于親本A549細(xì)胞(圖2H)。這些結(jié)果表明��,F(xiàn)EN1促進(jìn)了腫瘤在體內(nèi)和體外的進(jìn)展����。
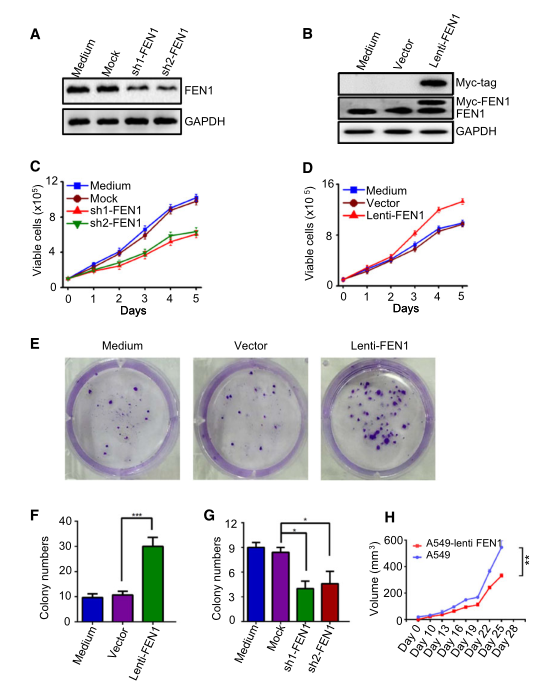
圖2
3. FEN1在A549細(xì)胞順鉑耐藥中的作用
鑒于FEN1在多個(gè)修復(fù)過程中的作用,例如BER�����、非同源末端連接、HR��、NER和錯(cuò)配修復(fù)等�,推測(cè)FEN1在腫瘤中的高水平表達(dá)與固有或獲得性耐藥有關(guān)�。為了驗(yàn)證這一假設(shè),研究者在不同F(xiàn)EN1水平的A549肺癌細(xì)胞中進(jìn)行了藥物敏感性實(shí)驗(yàn)�。結(jié)果表明,F(xiàn)EN1的過表達(dá)對(duì)順鉑具有保護(hù)作用(圖3A)����,同時(shí),F(xiàn)EN1基因敲除使A549細(xì)胞對(duì)順鉑敏感(圖3B)��。為了進(jìn)一步分析FEN1對(duì)細(xì)胞凋亡的影響�,研究者測(cè)定了順鉑處理后的亞G1期細(xì)胞比例。結(jié)果表明��,在順鉑作用下���,F(xiàn)EN1基因的敲除導(dǎo)致亞G1期細(xì)胞積聚(圖3C)��。FEN1的過表達(dá)減少了順鉑誘導(dǎo)的亞G1期片段的產(chǎn)生(圖3D)��。TUNEL染色顯示����,F(xiàn)EN1基因敲除細(xì)胞在順鉑處理后比對(duì)照細(xì)胞凋亡更多(圖3E,F(xiàn))��,而FEN1過表達(dá)細(xì)胞凋亡比對(duì)照細(xì)胞更少(圖3G���,H)����。這些數(shù)據(jù)表明FEN1對(duì)順鉑誘導(dǎo)的細(xì)胞凋亡具有保護(hù)作用���。
研究者開發(fā)耐藥細(xì)胞����,并設(shè)計(jì)實(shí)驗(yàn)來評(píng)估克服順鉑耐藥性的可能性����。研究者將從A549肺癌細(xì)胞中建立的順鉑耐藥細(xì)胞命名為A549-順鉑-R細(xì)胞或簡(jiǎn)稱為A549-R。使用10和20微升的FEN1抑制劑C20處理A549-R細(xì)胞3天���。結(jié)果顯示�,A549-R細(xì)胞對(duì)順鉑的耐藥性部分喪失�����。
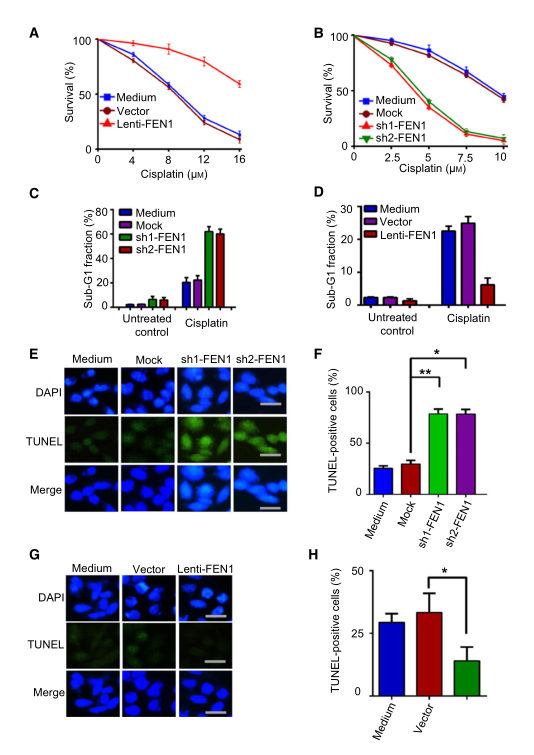
圖3
4. FEN1表達(dá)對(duì)順鉑誘導(dǎo)的A549細(xì)胞DNA損傷修復(fù)的影響
順鉑所致?lián)p傷的修復(fù)缺陷可導(dǎo)致未修復(fù)的DNA中間體和DNA雙鏈斷裂(DSB)的積聚。因此���,研究者預(yù)測(cè)FEN1下調(diào)的細(xì)胞將比對(duì)照細(xì)胞表現(xiàn)出更高水平的DNA雙鏈斷裂��。為了驗(yàn)證假設(shè),研究者確定了細(xì)胞中DNA雙鏈斷裂的標(biāo)志物cH2AX和53BP1的病灶���。的確����,F(xiàn)EN1的下調(diào)導(dǎo)致了cH2AX(圖4A���,B)和53BP1(圖4E�,F(xiàn))在細(xì)胞中的積累���。相反�,F(xiàn)EN1過表達(dá)降低了順鉑誘導(dǎo)細(xì)胞內(nèi)cH2AX(圖4C��,D)和53BP1(圖4G�����,H)的病灶形成水平。順鉑引起的未修復(fù)DNA損傷的積累將導(dǎo)致染色體斷裂���。為了測(cè)試FEN1對(duì)順鉑誘導(dǎo)的染色體斷裂的影響�����,研究者分析了中期細(xì)胞核的染色體畸變���。與對(duì)照親本細(xì)胞相比,F(xiàn)EN1缺陷細(xì)胞的染色體片段和斷裂水平顯著增加(圖4I-J)�����。然而��,高FEN1表達(dá)水平的細(xì)胞顯示染色體斷裂水平降低(圖4K)�����。
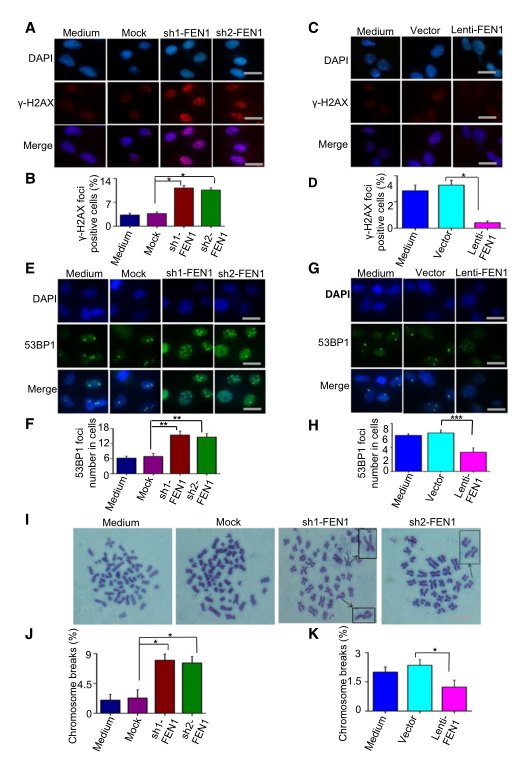
圖4
5. FEN1抑制劑導(dǎo)致未修復(fù)的DSB積聚并增強(qiáng)對(duì)順鉑的敏感性
基于以上結(jié)果����,研究者推測(cè)FEN1特異性抑制劑可以作為一種抗癌藥物��,既可以單獨(dú)使用來抑制癌細(xì)胞的生長(zhǎng)���,也可以與DNA損傷誘導(dǎo)劑聯(lián)合使用來提高治療效果。研究者使用一種FEN1抑制劑C20驗(yàn)證假設(shè)����,為了確定靶向抑制FEN1能否增強(qiáng)順鉑在A549細(xì)胞中的活性,用C20預(yù)處理A549細(xì)胞���,然后用不同濃度的順鉑處理48h,圖5A顯示C20處理的細(xì)胞存活率顯著降低�。與僅用順鉑處理的細(xì)胞相比,C20和順鉑處理的細(xì)胞顯示出更多的cH2AX和53BP1病灶(圖5B-E)�。為了評(píng)價(jià)FEN1抑制劑對(duì)不同F(xiàn)EN1水平細(xì)胞的毒性,研究者還比較了C20在不同肺癌細(xì)胞系中的IC50��。結(jié)果顯示A549���、H1299和H460細(xì)胞增殖呈劑量依賴性下降�,IC50分別為12.5�����、22.1和20.81M(圖5F)。值得注意的是���,F(xiàn)EN1表達(dá)水平低的細(xì)胞對(duì)FEN1抑制劑的敏感性較低�����。提示FEN1在不同癌細(xì)胞中的表達(dá)可能與其對(duì)FEN1抑制劑的敏感性有關(guān)�����。
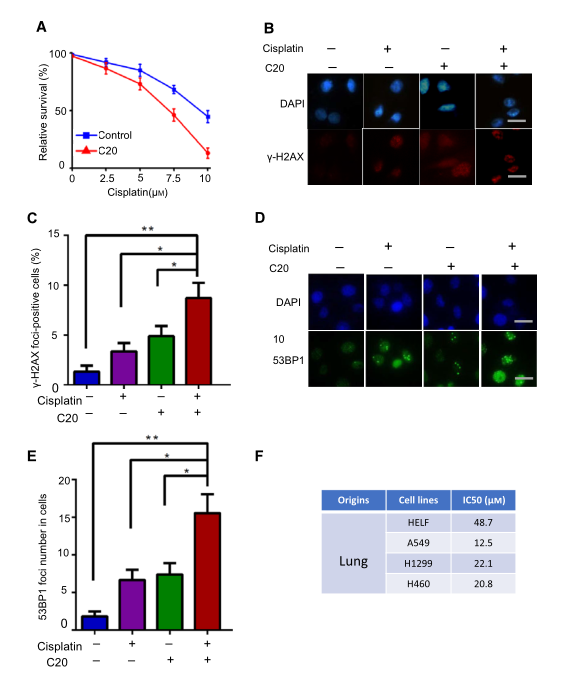
圖5
6. 抑制FEN1對(duì)移植瘤小鼠的抗腫瘤作用
為了進(jìn)一步研究抑制FEN1對(duì)體內(nèi)腫瘤進(jìn)展的影響����,研究者用裸鼠進(jìn)行了異種移植研究�。結(jié)果顯示,對(duì)照組小鼠腫瘤體積以時(shí)間依賴的方式逐漸增大�����。單獨(dú)使用順鉑或FEN1抑制劑治療后����,移植瘤的生長(zhǎng)略有下降(圖6A)。當(dāng)順鉑與FEN1抑制劑聯(lián)合應(yīng)用時(shí),腫瘤生長(zhǎng)明顯減少��。同時(shí)�����,聯(lián)合治療組動(dòng)物存活率也有所提高(圖6B)��。這些結(jié)果表明��,抑制FEN1可以增強(qiáng)順鉑對(duì)小鼠肺癌移植瘤的療效��。
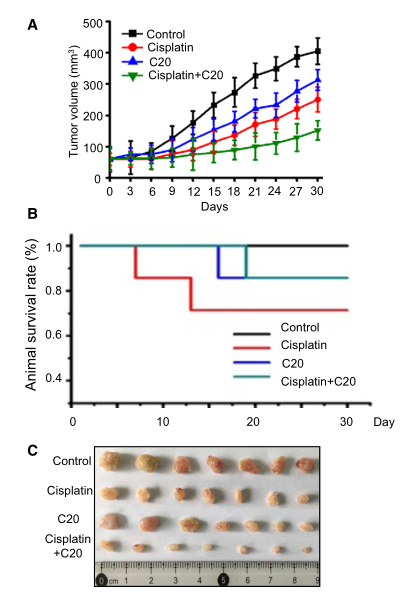
圖6
7. FEN1的下調(diào)或抑制激活了細(xì)胞凋亡的內(nèi)在途徑
P53通路是最常見的細(xì)胞凋亡機(jī)制���。在應(yīng)激狀態(tài)下����,p53被磷酸化后激活���,并作為轉(zhuǎn)錄因子激活凋亡相關(guān)基因的表達(dá)。研究者檢測(cè)了FEN1缺乏誘導(dǎo)的細(xì)胞凋亡是否依賴于p53���,發(fā)現(xiàn)順鉑(圖7A)誘導(dǎo)P53和磷酸化的P53�����,表明其激活了P53通路��。作為p53激活的下游事件�,A549細(xì)胞中的凋亡指標(biāo)caspase-3也在順鉑作用下上調(diào)。此外���,c-H2AX顯示DNA損傷程度與凋亡指標(biāo)上調(diào)相關(guān)����,順鉑可上調(diào)DNA損傷程度(圖7A)����。
為了明確DNA損傷是否可以誘導(dǎo)凋亡反應(yīng),研究者用FEN1 siRNA處理A549細(xì)胞�����,并檢測(cè)了A549細(xì)胞的凋亡反應(yīng)����。結(jié)果顯示,F(xiàn)EN1基因敲除增加了FC-H2AX的水平�����。同時(shí),F(xiàn)EN1基因敲除后���,磷酸化的p53和caspase-3的表達(dá)也被上調(diào)���,這與順鉑處理結(jié)果類似(圖7B)。這些數(shù)據(jù)表明�,DNA損傷是由FEN1基因敲除引起的,并可能誘導(dǎo)p53依賴的細(xì)胞凋亡����。為了進(jìn)一步證實(shí)FEN1和DNA損傷水平在順鉑誘導(dǎo)的細(xì)胞凋亡中的作用,研究者測(cè)定了FEN1過表達(dá)的A549細(xì)胞對(duì)順鉑的反應(yīng)�。如圖7C所示,F(xiàn)EN1的過表達(dá)減少了順鉑誘導(dǎo)的DNA損傷�����,順鉑誘導(dǎo)的p53活化和caspase-3形成也明顯減少�����。這一結(jié)果表明�,F(xiàn)EN1通過減少細(xì)胞內(nèi)DNA損傷來保護(hù)細(xì)胞免受順鉑誘導(dǎo)的凋亡。
接下來���,研究者對(duì)圖6C中的腫瘤進(jìn)行了免疫組化檢測(cè)����。結(jié)果如圖7D所示���,與caspase-3和TUNEL陽性細(xì)胞處理相比�,順鉑和FEN1抑制劑聯(lián)合使用對(duì)細(xì)胞凋亡顯示出更大的協(xié)同作用�����。此外���,c-H2AX和53BP1染色表明�����,與FEN1抑制劑或順鉑單獨(dú)治療相比�����,F(xiàn)EN1抑制劑和順鉑聯(lián)合治療可在腫瘤中產(chǎn)生更多的DSB���,這與先前的研究結(jié)果一致��。綜上所述�,上述結(jié)果提示FEN1下調(diào)或抑制激活了p53介導(dǎo)的內(nèi)在凋亡途徑����。
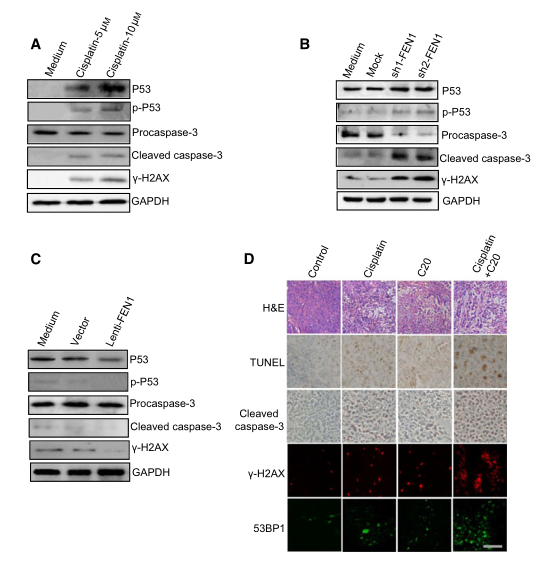
圖7










 實(shí)驗(yàn)熱線:4006991663
實(shí)驗(yàn)熱線:4006991663









