
背景:
強(qiáng)制性表達(dá)轉(zhuǎn)錄因子OCT4、SOX2�、KLF4和c-MYC(OSKM)可將體細(xì)胞重編程為誘導(dǎo)多能干細(xì)胞(IPSC)。在重編程開(kāi)始時(shí),外源OSKM與整個(gè)基因組的DNA結(jié)合����,并誘導(dǎo)連續(xù)幾輪染色質(zhì)重組,從而激活整個(gè)多能性基因網(wǎng)絡(luò)�����。然而�,OSKM不是孤立運(yùn)作的,需要與共同的調(diào)節(jié)者(共激活因子和共抑制因子)合作來(lái)有效重塑表觀遺傳環(huán)境����,但這種相互作用是如何調(diào)節(jié)的�����,目前仍知之甚少��。
內(nèi)容概述:
2018年6月�,中國(guó)科學(xué)院廣州生物醫(yī)藥與健康研究院再生生物學(xué)重點(diǎn)實(shí)驗(yàn)室在國(guó)際期刊Nature Cell Biology(IF2017=19.064)上發(fā)表了題為“NCoR/SMRT co-repressors cooperate with c-MYC to create an epigenetic barrier to somatic cell reprogramming“的最新論文��,首次發(fā)現(xiàn)NCoR/SMRT共抑制子通過(guò)其核心表觀遺傳亞基“組蛋白去乙?����;?(HDAC3) ”�����,去除基因組多能基因位點(diǎn)上的“活性標(biāo)記”H3K27ac��,從而抑制四個(gè)山中因子(OCT4��、SOX2��、KLF4和c-MYC)介導(dǎo)的重新編程���。此外�����,山中因子中的c-MYC可以募集NCoR/SMRT-HDAC3到基因組位點(diǎn)�,有助于解釋“為什么包含c-MYC的重編程體系更容易產(chǎn)生不完全重編程”的現(xiàn)象。本研究不僅揭示了NCoR/SMRT共抑制子在重編程中的作用�����,而且提出了c-MYC在這一過(guò)程中的雙重功能����。
主要技術(shù):
RNA-seq、ChIP��、Co-IP�、基因過(guò)表達(dá)/干擾等�����;
輝駿生物為本研究提供了蛋白檢測(cè)和分析服務(wù)�����。
研究路線:

研究結(jié)果:
1. NCoR/SMRT抑制OSKM重編程
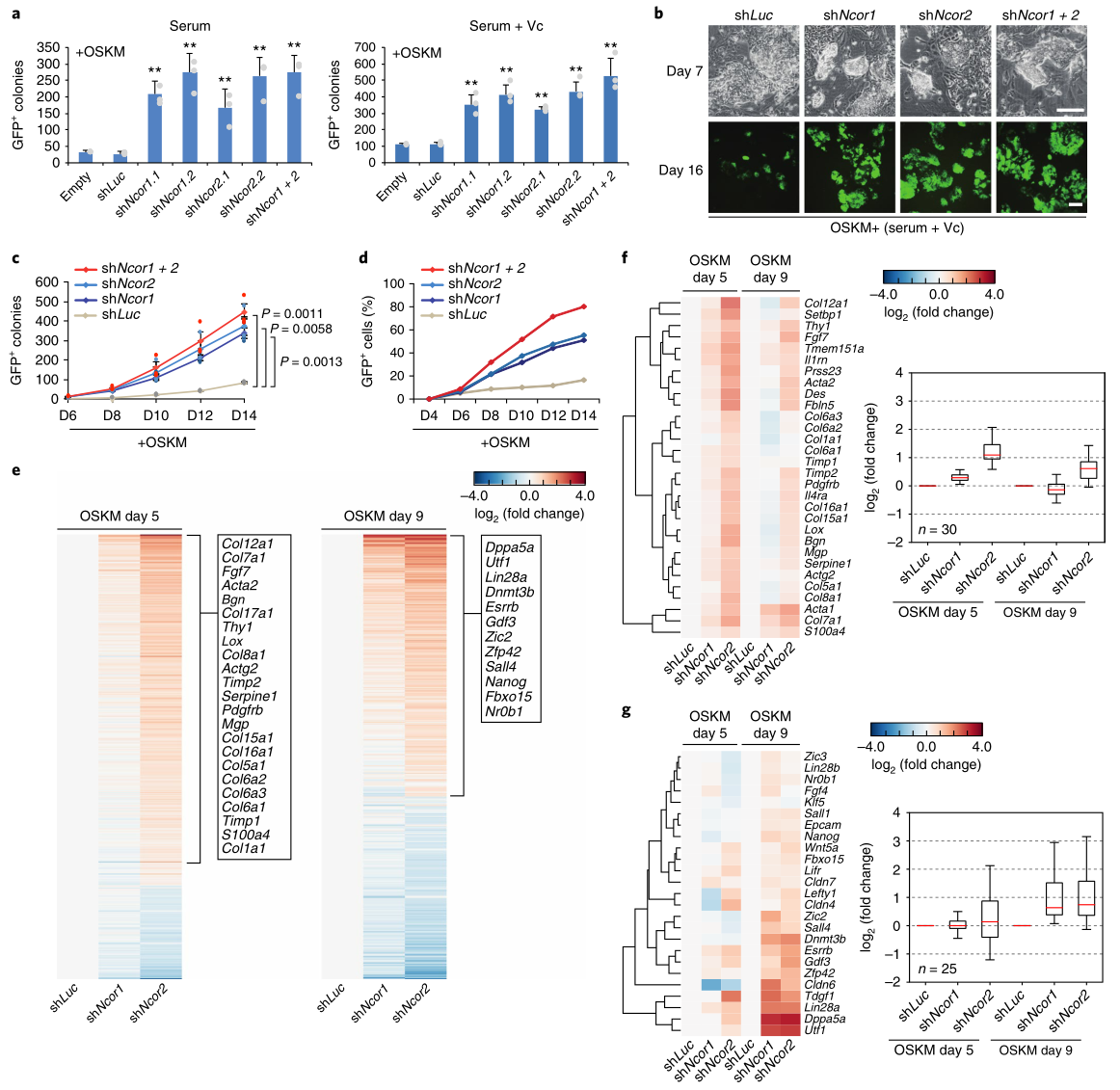
首先,研究者首先發(fā)現(xiàn)Ncor1(編碼NCoR)和Ncor2(編碼SMRT)在小鼠胚胎成纖維細(xì)胞(MEF)��、胚胎干細(xì)胞(ESC)和OSKM重編程細(xì)胞中均有表達(dá)��。無(wú)論用怎樣的轉(zhuǎn)導(dǎo)方法���、報(bào)告系統(tǒng)�、MEF類型或培養(yǎng)基���,抑制Ncor1/2的表達(dá)都能增強(qiáng)OSKM誘導(dǎo)的重編程(圖1a-c)�����。
RNA-seq發(fā)現(xiàn)Ncor1/2敲除細(xì)胞在OSKM重編程時(shí)的基因表達(dá)譜很相似(圖1e)�����,但Ncor2敲除的整體效應(yīng)更強(qiáng)(圖1e)����。許多體細(xì)胞基因在OSKM 第5天上調(diào)��,在第9天變得不明顯(圖1f),而與間充質(zhì)-上皮轉(zhuǎn)化有關(guān)的基因在這兩個(gè)時(shí)間點(diǎn)都沒(méi)有受到影響���。OSKM第9天出現(xiàn)了多能基因的上調(diào)�。這些結(jié)果表明�����,在OSKM重編程中敲除Ncor1/2先是暫時(shí)減弱了對(duì)體細(xì)胞基因的抑制�����,接著是加快和更有效地激活多能性基因�。
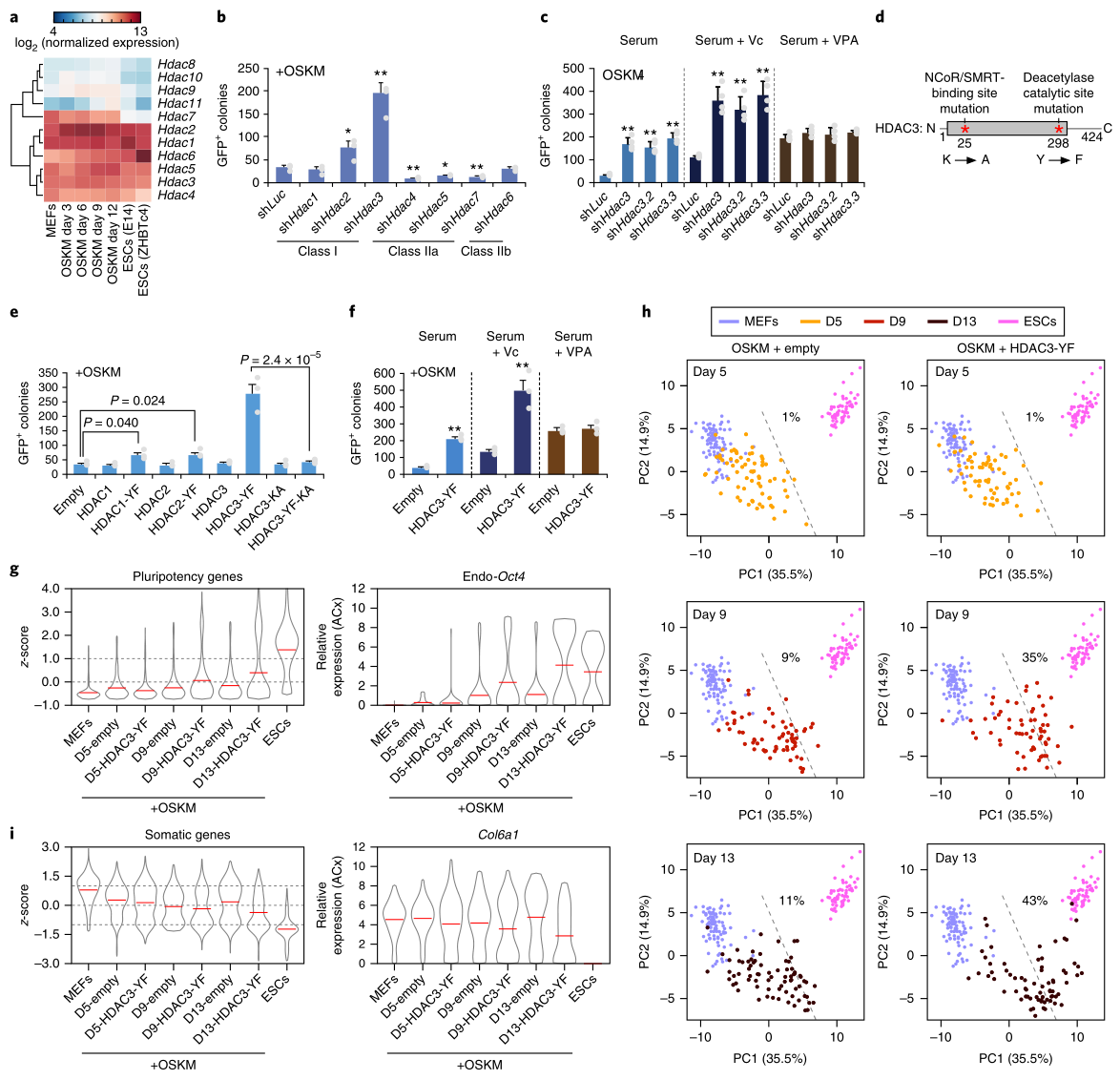
2. NCoR/SMRT共抑制因子需要HDAC3來(lái)破壞重新編程
NCoR和SMRT可以通過(guò)轉(zhuǎn)錄因子和表觀遺傳修飾因子(如組蛋白脫乙酰酶HDAC)調(diào)控染色質(zhì)。泛HDAC抑制劑(VPA和TSA)能促進(jìn)重編程�,因此推測(cè)HDAC可能參與NCoR/SMRT抑制OSKM重編程的過(guò)程。據(jù)報(bào)道���,HDAC1���、2、3���、4、5、7都能與NCoR/SMRT相互作用����,因此研究人員全面檢測(cè)了HDAC1到HDAC11在MEF、ESC和OSKM重編程細(xì)胞中的表達(dá):HDAC1到HDAC6在三類細(xì)胞中都有表達(dá)(圖2a)�。接著,他們研究了敲除HDAC的效果����,發(fā)現(xiàn)只有HDAC3敲除顯著促進(jìn)了重編程 (圖2b)。此外���,VPA的加入不影響HDAC3敲除細(xì)胞的重編程(圖2c)��,表明泛HDAC抑制劑通過(guò)抑制HDAC3促進(jìn)OSKM重編程�。接下來(lái)�,研究者制備了2個(gè)HDAC3突變體HDAC3-YF(缺乏去乙酰酶活性)和HDAC3-YF-KA(既缺乏去乙酰酶活性,也缺乏結(jié)合NCoR/SMRT的能力)(圖2d)�;同時(shí)以HDAC1-YF和HDAC2-YF做對(duì)照。結(jié)果顯示�,過(guò)表達(dá)HDAC3-YF顯著增強(qiáng)了OSKM重編程(圖2e);VPA不影響HDAC3-YF重編程的程度(圖2f)�����;HDAC3-YF-KA突變體不再促進(jìn)重編程,表明HDAC3-YF需要結(jié)合NCoR/SMRT來(lái)發(fā)揮作用 (圖2d����,e)。另外��,HDAC3-YF過(guò)表達(dá)細(xì)胞重編程的第9和13天(尤其是第13天)�,許多多能基因的表達(dá)都升。
這些結(jié)果表明�����,HDAC3介導(dǎo)的NCoR/SMRT對(duì)OSKM重編程的抑制需要去乙酰酶活性�����;但是抑制NCoR/SMRT或HDAC3對(duì)體細(xì)胞基因的影響不同����,這可能是由于靶位點(diǎn)上NCoR/SMRT的缺失影響了其他酶的活性,或是招募了一些激活因子�。
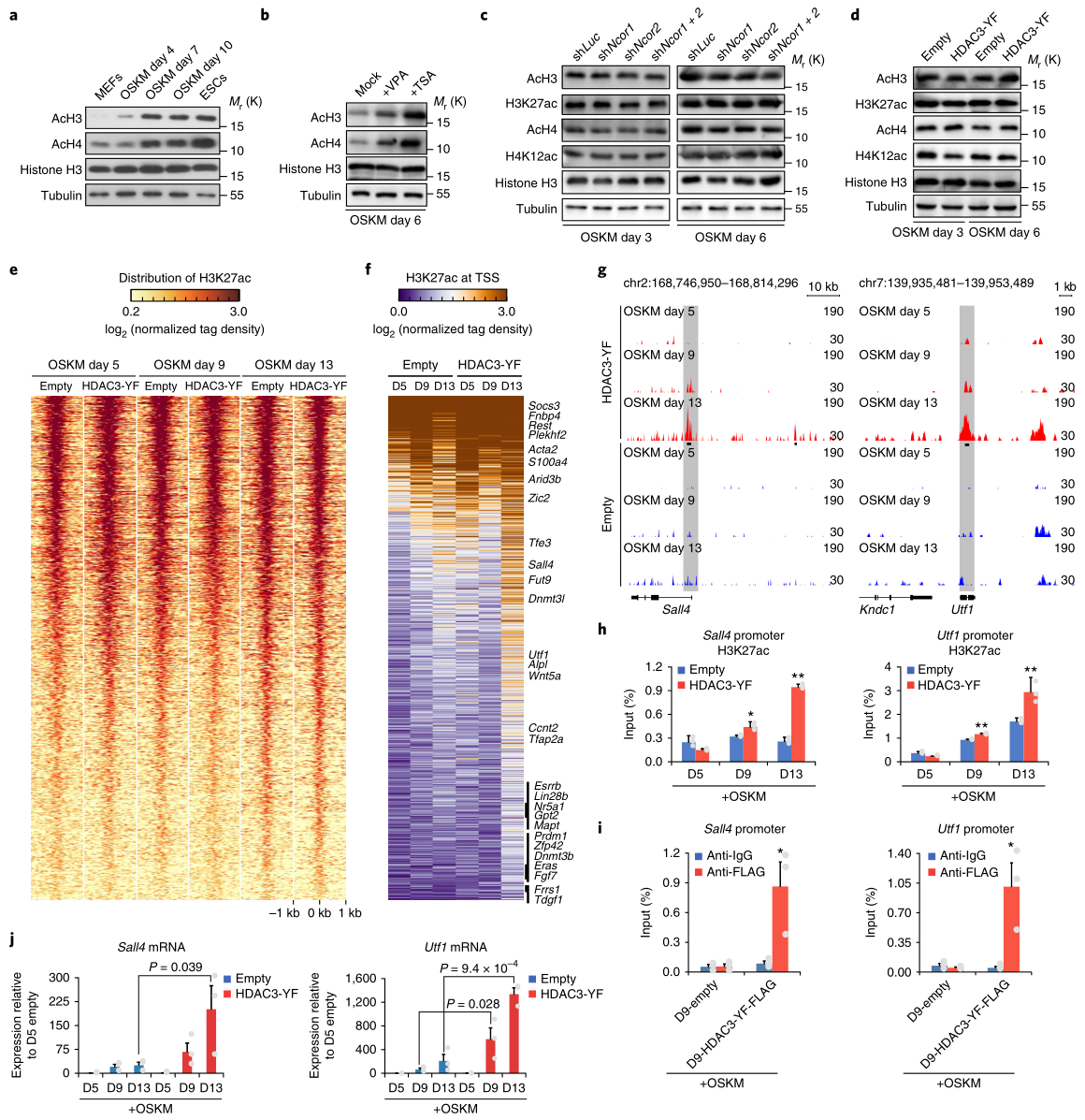
3. HDAC3通過(guò)誘導(dǎo)多能基因位點(diǎn)的組蛋白去乙酰化來(lái)抑制重編程
接著�,研究者發(fā)現(xiàn)組蛋白H3乙酰化(AcH3)和組蛋白H4乙?����;?AcH4)在ESC中的水平均高于MEF(圖3a)����;在VPA或TSA增強(qiáng)的OSKM重編程細(xì)胞中,其水平也均有增加(圖3b)����,但是在NCoR/SMRT缺失或HDAC3-YF過(guò)表達(dá)的OSKM重編程細(xì)胞中,它們的水平?jīng)]有增加��,另外受NCoR/SMRT-HDAC3調(diào)控的代表性的乙?��;M蛋白H3K27ac和H4K12ac的水平也沒(méi)有增加(圖3c�����,d)�。
接著�,HDAC3-YF誘導(dǎo)OSKM重編程的細(xì)胞進(jìn)行了H3K27ac 的ChIP-seq實(shí)驗(yàn),研究組蛋白乙?����;恼w影響(圖3e)。結(jié)果顯示�����,大多數(shù)H3K27ac位于轉(zhuǎn)錄起始位點(diǎn)(TSS)附近�����。之后的檢測(cè)進(jìn)一步發(fā)現(xiàn)��,H3K27ac水平較高的多為多能性相關(guān)基因(圖3f)��;在重編程后期�,4個(gè)多能基因座(Sall4、Utf1��、Nanog和Zic2)都表現(xiàn)出H3K27ac的增加(圖3g)��,H3K27ac的ChIP-qPCR驗(yàn)證了這一結(jié)果(圖3h)�;在重編程的第9天,HDAC3-YF 的ChIP-qPCR(圖3i)也發(fā)現(xiàn)這些基因座被顯著富集了(圖3i)��,表明HDAC3-YF過(guò)表達(dá)直接影響OSKM重編程中H3K27ac的水平��,H3K27ac的水平與這些多能基因的水平呈相關(guān)性(圖3j)��。
綜上所述,HDAC3可能作為NCoR/SMRT復(fù)合體的一部分��,使特定基因位點(diǎn)(如多能基因位點(diǎn))發(fā)生組蛋白去乙?����;?�,從而抑制OSKM重編程�。
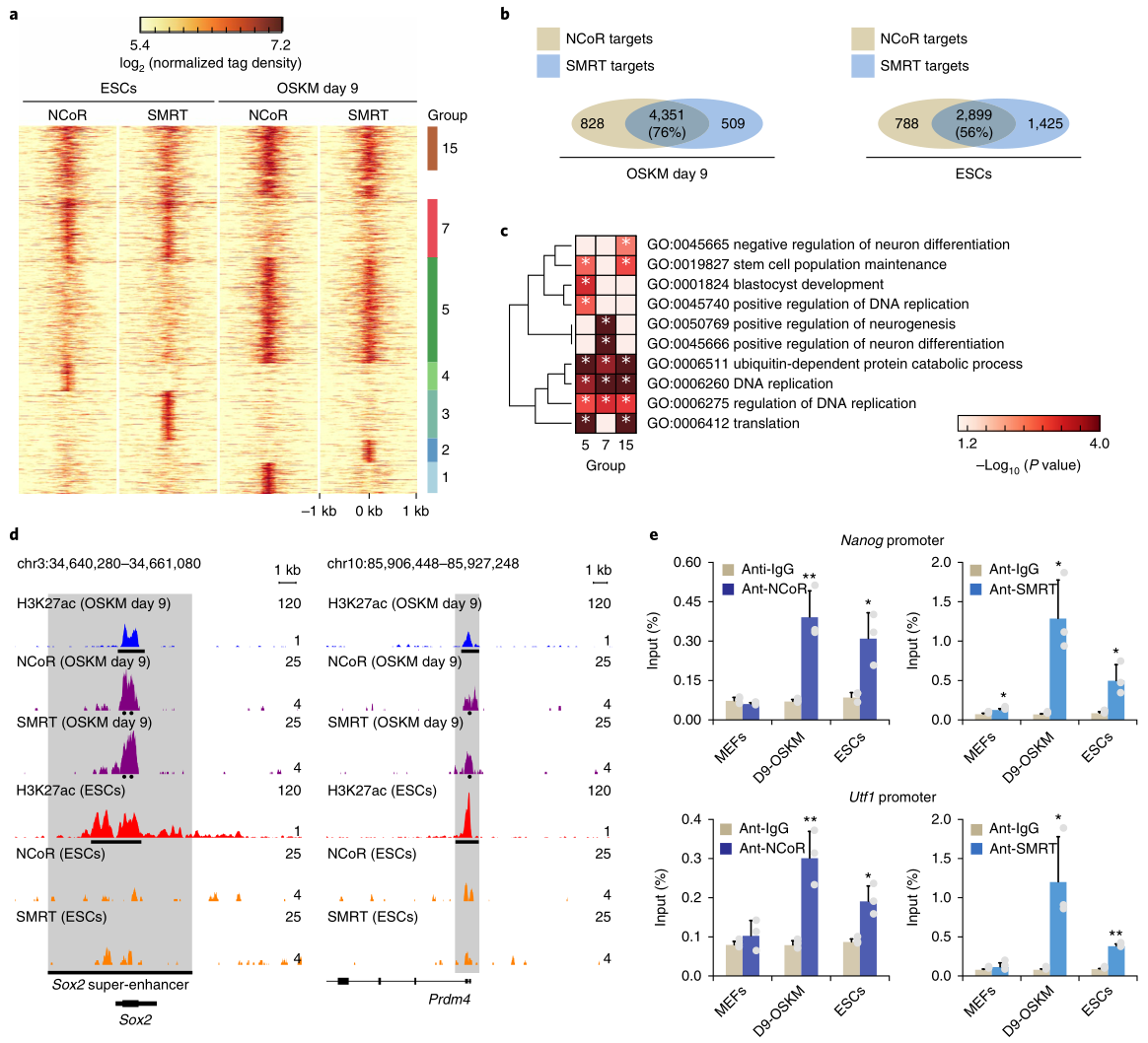
4. NCoR/SMRT通過(guò)HDAC3介導(dǎo)的組蛋白去乙?����;种贫嗄苄曰蚣せ?/strong>
研究者對(duì)OSKM重編程細(xì)胞進(jìn)行了NCoR/SMRT的CHIP Seq實(shí)驗(yàn)��,結(jié)果顯示����,在ESC和重編程細(xì)胞中,NCoR與SMRT的結(jié)合峰有很多重疊的(圖4a�����,b)�����,這些峰大多位于TSS附近,這與H3K27ac的ChIP-seq數(shù)據(jù)一致����。GO分析顯示,重編程特有的結(jié)合峰或重編程與ESC細(xì)胞共有的結(jié)合峰�����,大多與干細(xì)胞相關(guān)(圖4c)�,例如多能性基因Sox2和Prdm4僅在重編程細(xì)胞中與NCoR/SMRT結(jié)合,且這些基因座的H3K27ac水平在重編程中比ESC中更低(圖4d)���,與之前認(rèn)為NCoR/SMRT通過(guò)HDAC3去乙?�;淖饔脕?lái)抑制重編程的結(jié)論相符�����。ChIP-qPCR證實(shí)了在重編程時(shí)NCoR/SMRT與Nanog和Utf1啟動(dòng)子結(jié)合��,而在ESC中的結(jié)合較少(圖4e)����,在MEF中幾乎不能結(jié)合。ESC特有的NCoR/SMRT結(jié)合峰���,大多與分化相關(guān)(圖4c)��,但敲除NCoR/SMRT并不能誘導(dǎo)分化����。
這些結(jié)果表明��,NCoR/SMRT被招募到多能基因位點(diǎn)抑制重編程��,但在ESC中����,它們具有不同的功能���,這可能與發(fā)育過(guò)程中的組織特異性有關(guān)��。
重編程中NCoR/SMRT的招募與H3K27ac水平呈反相關(guān)�,在重編程為多能細(xì)胞時(shí)伴隨著H3K27ac水平的升高��。為了確定這一發(fā)現(xiàn)是否適用于所有的NCoR/SMRT結(jié)合基因����,以及HDAC3-YF過(guò)表達(dá)是否有助于增加NCoR/SMRT靶位點(diǎn)的H3K27ac水平��,他們?cè)贖DAC3-YF/空載誘導(dǎo)重編程細(xì)胞以及ESC細(xì)胞中���,檢測(cè)了NCoR/SMRT靶位點(diǎn)的H3K27ac水平,發(fā)現(xiàn)重編程第5天的H3K27ac水平較低�����,在第13天最高(圖5a-d)�,其中HDAC3-YF過(guò)表達(dá)組上調(diào)更明顯;另外ESC中的H3K27ac水平也較高�。之后,他們對(duì)NCoR/SMRT結(jié)合的一組多能基因在TSS的2kb范圍內(nèi)進(jìn)行了qPCR����。發(fā)現(xiàn)無(wú)論過(guò)表達(dá)HDAC3-YF或敲除Ncor1/2時(shí),重編程過(guò)程中H3K27ac水平的升高與多能基因表達(dá)的增加均有很好的相關(guān)性(圖5e)����。這些結(jié)果證實(shí)了NCoR/SMRT通過(guò)HDAC3介導(dǎo)的組蛋白去乙酰化來(lái)抑制多能性基因的激活���。
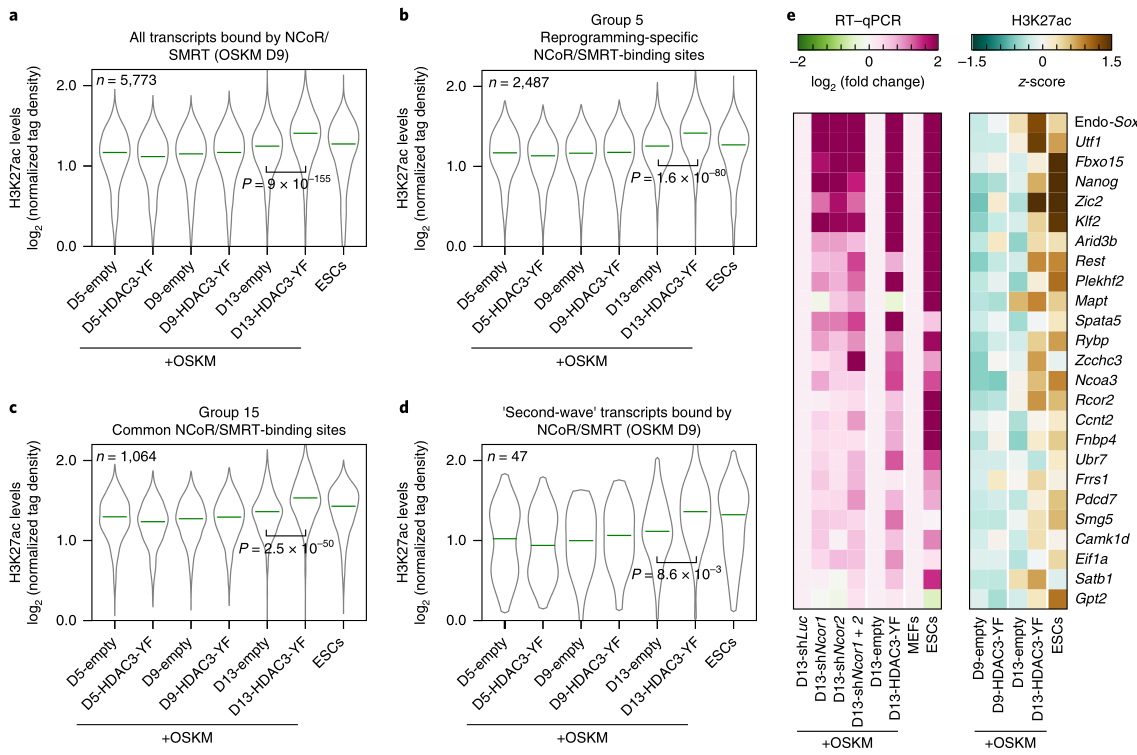
5. c-MYC在重編程時(shí)招募了NCoR/SMRT-HDAC3復(fù)合體
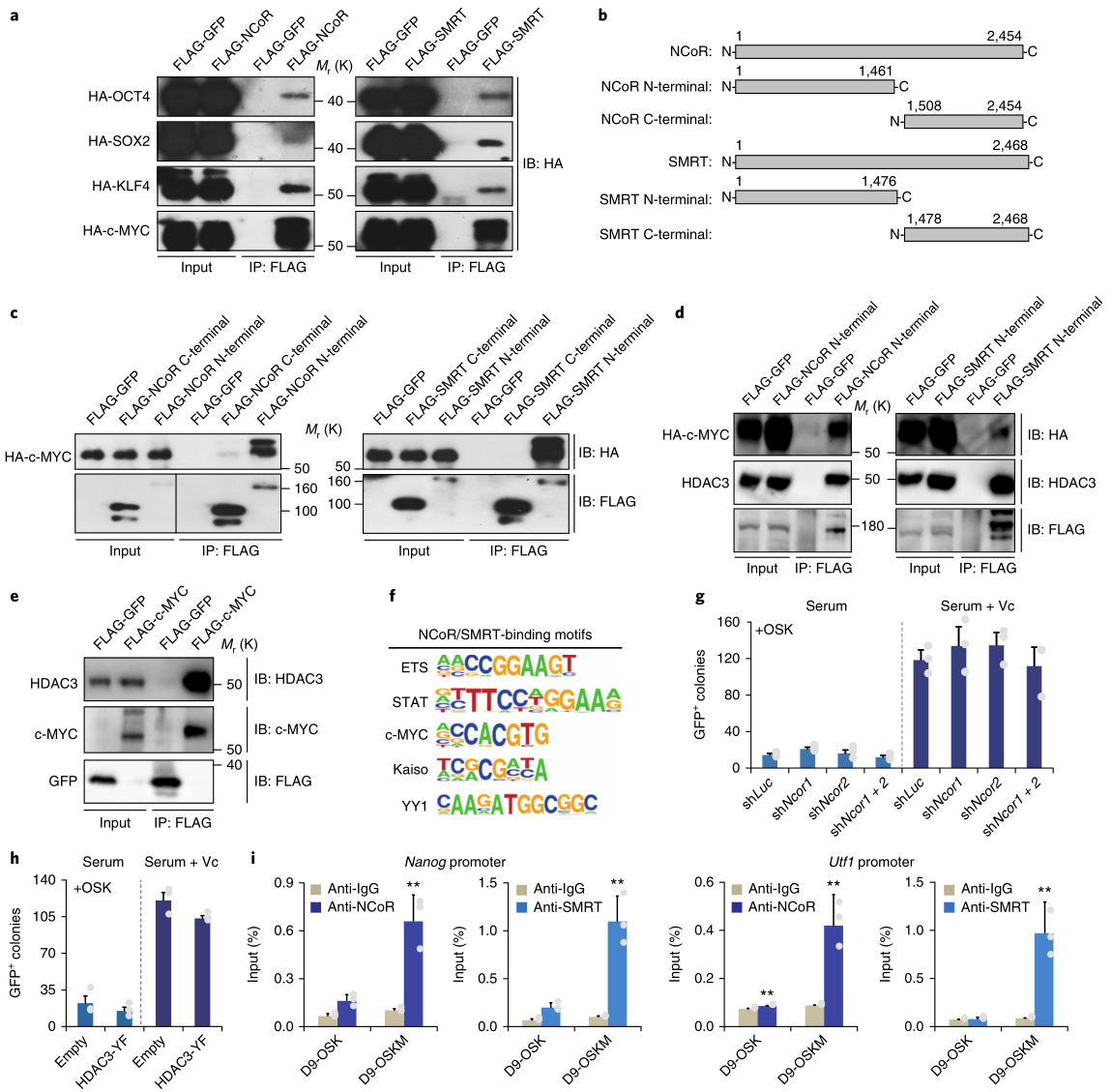
外源OSKM因子可能參與了NCoR/SMRT-HDAC3與特定基因位點(diǎn)的結(jié)合��。HEK293T細(xì)胞的免疫共沉淀(Co-IP)證實(shí)了OSKM4個(gè)因子均與NCoR/SMRT相互作用�,其中c-MYC的結(jié)合更強(qiáng)(圖6a);NCoR/SMRT的N端結(jié)構(gòu)域是c-MYC-NCoR/SMRT相互作用所必需的 (圖6b�����,c)����。CoIP實(shí)驗(yàn)表明,NCoR/SMRT的N端結(jié)構(gòu)域可以共沉淀c-MYC和內(nèi)源性的HDAC3 (圖6d)�,外源性c-MYC可以共沉淀內(nèi)源性的HDAC3(圖6e),說(shuō)明HDAC3可以和c-MYC-NCoR/SMRT相互作用���。ChIP-seq分析發(fā)現(xiàn),NCoR/SMRT中還存在著一個(gè)c-MYC結(jié)合基序(圖6f)�����。此外����,NCoR1/2基因敲除未能提高OSK的重編程效率(圖6g),HDAC3-YF的表達(dá)對(duì)OSK的重編程也沒(méi)有有利影響(圖6h);NCoR/SMRT的ChIP–qPCR表明�����,Nanog和Utf1位點(diǎn)在OSK誘導(dǎo)的重編程中不能被富集(圖6i)����。
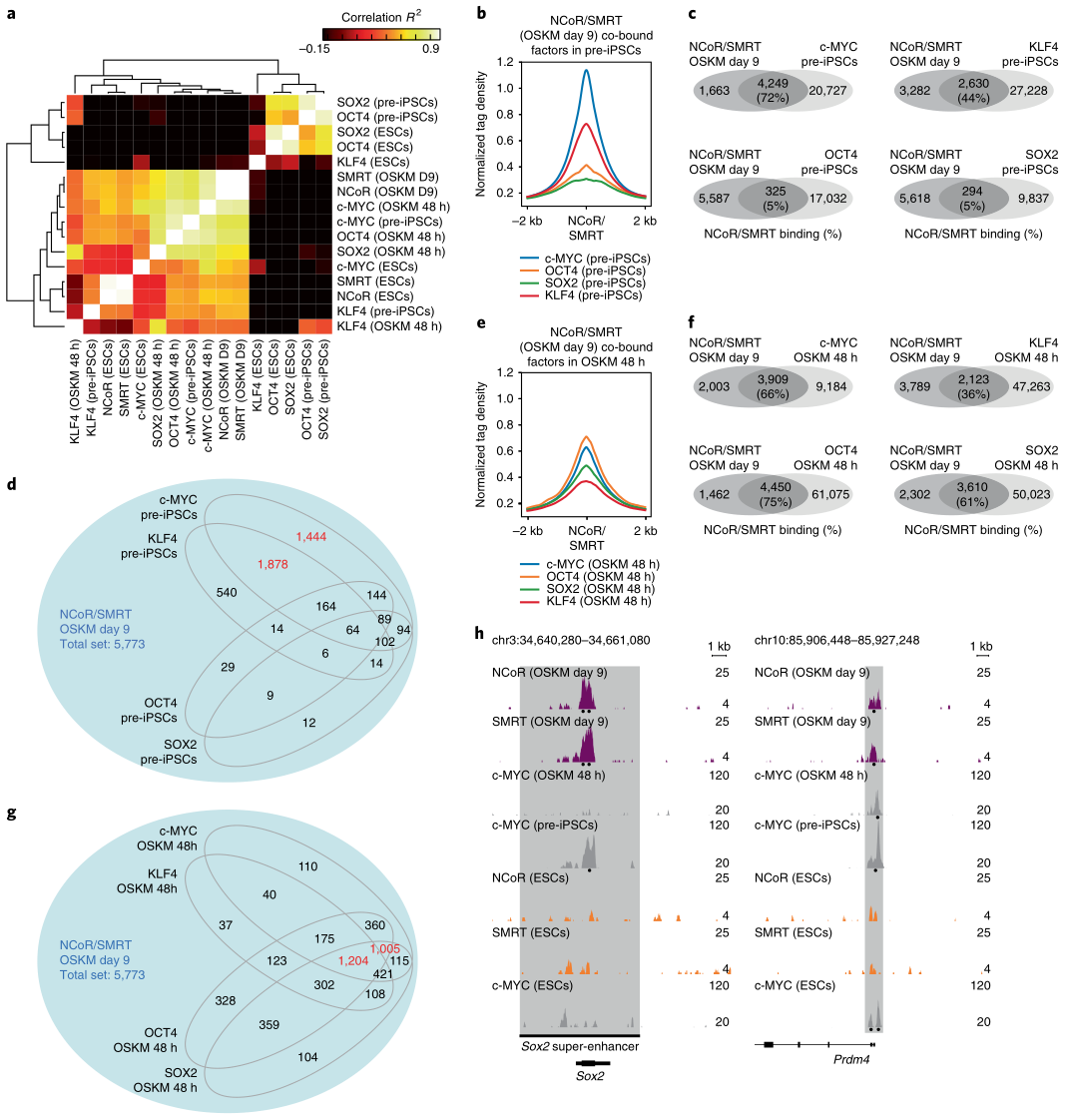
根據(jù)NCoR/SMRT的ChIP-seq數(shù)據(jù)及其GEO庫(kù)下載的(OSKM四因子在pre-iPSCs, 48h OSKM重編程和ESC細(xì)胞的)ChIP–seq數(shù)據(jù),研究者分析了NCoR/SMRT和OSKM四因子的結(jié)合位點(diǎn)相關(guān)性(圖7a)�,在pre-iPSCs中,NCoR/SMRT與c-MYC的結(jié)合位點(diǎn)重疊最高���,其次是KLF4和OCT4/SOX2(圖7b�����,c)�����,其中KLF4重疊位點(diǎn)大部分也與c-MYC結(jié)合 (圖7d)��,說(shuō)明c-MYC可能招募了NCoR/SMRT到這些位點(diǎn)��。在48h OSKM重編程細(xì)胞中����,NCoR/SMRT與OCT4、SOX2和c-MYC的結(jié)合位點(diǎn)都有大概60-70%的重疊�,并且這些位點(diǎn)大部分是三因子共有的(圖7e-g)。86%的c-MYC重疊位點(diǎn)在iPSCs中也存在�,說(shuō)明c-myc在重編程早期招募了NCoR/SMRT到這些位點(diǎn),GO富集分析顯示��,這些位點(diǎn)基因富集在干細(xì)胞或囊胚相關(guān)的條目里�����。相反��,9天OSKM重編程和ESCs中的NCoR/SMRT結(jié)合位點(diǎn)與ESCs中c-MYC(或OSK)的沒(méi)有太多重疊��,說(shuō)明NCoR/SMRT在重編程和ESCs中具有不同的功能�����。
綜上���,在四個(gè)山中因子中,c-MYC最有助于將NCoR/SMRT募集到基因組位點(diǎn)(包括多能性位點(diǎn))���,從而對(duì)重編程產(chǎn)生負(fù)面影響��。
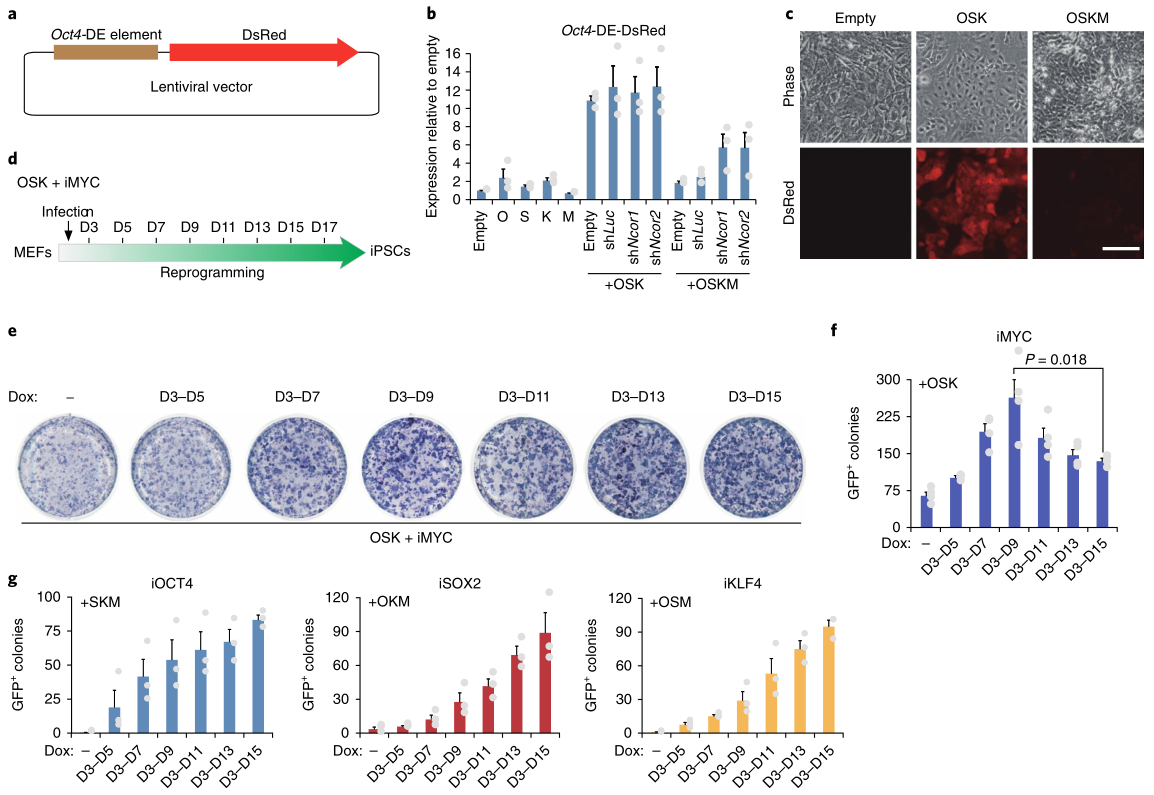
6. 外源c-MYC在重編程中的雙重作用
為了進(jìn)一步評(píng)估c-MYC和NCoR/SMRT在重編程中抑制多能基因的作用關(guān)系�����,研究者制備了由Oct4末端增強(qiáng)子(Oct4-DE)驅(qū)動(dòng)的DsRed報(bào)告基因慢病毒 (圖8a)并整合到細(xì)胞基因組���,發(fā)現(xiàn)OCT4���、SOX2或KLF4在MEF中的單獨(dú)過(guò)表達(dá)略微激活了報(bào)告因子,但它們的組合具有協(xié)同作用(圖8b�����,c)�����。相比之下�����,c-MYC單獨(dú)沒(méi)有激活作用�,但與OSK結(jié)合使用會(huì)削弱報(bào)告基因活性的增加(圖8b�,c)�,Ncor1/2的敲除部分緩解了c-MYC對(duì)報(bào)告基因的抑制(圖8b),這些結(jié)果表明�����,c-MYC募集NCoR/SMRT共抑制子到多能基因位點(diǎn)將不利于重編程��,但這與之前的研究OSKM可誘導(dǎo)重編程的結(jié)論不一致��。因此����,研究者進(jìn)一步用OSK和多西環(huán)素誘導(dǎo)的c-MYC重編程MEF(圖8d)。c-MYC誘導(dǎo)的第3-9天�����,干細(xì)胞標(biāo)記物堿性磷酸酶陽(yáng)性的細(xì)胞數(shù)量達(dá)到峰值�����,不會(huì)隨著時(shí)間延長(zhǎng)進(jìn)一步增加(圖8e)����。c-MYC誘導(dǎo)后第3-9天Oct4-GFP+細(xì)胞數(shù)量也達(dá)到高峰,但隨著誘導(dǎo)時(shí)間延長(zhǎng)明顯減少(圖8f)���;相反���,OSK三因子的誘導(dǎo)在重編程的所有階段都是有益的。這些結(jié)果表明�,外源性c-MYC通過(guò)招募NCoR/SMRT-HDAC3抑制多能基因?qū)χ鼐幊掏砥谑遣焕摹?/span>
結(jié)論:
本研究發(fā)現(xiàn)NCoR/SMRT–HDAC3共抑制復(fù)合物通過(guò)與OSKM因子(尤其是c-MYC)相互作用為重編程制造障礙,這一發(fā)現(xiàn)揭示了c-MYC在重編程中的雙重作用����,也有助于解釋為何用OSKM而非OSK誘導(dǎo)重編程更容易產(chǎn)生pre-iPSCs,以及為何用HDAC抑制劑對(duì)OSKM而非OSK誘導(dǎo)的重編程能產(chǎn)生更強(qiáng)的效果等問(wèn)題���。










 實(shí)驗(yàn)熱線:4006991663
實(shí)驗(yàn)熱線:4006991663












