
內(nèi)容概述:
2022年3月����,輝駿生物的合作伙伴——中山大學中山眼科中心團隊在期刊Advanced Science(IF2020=16.806)上發(fā)表題為“MYPT1/PP1-Mediated EZH2 Dephosphorylation at S21 Promotes Epithelial-Mesenchymal Transition in Fibrosis through Control of Multiple Families of Genes “的文章。實驗發(fā)現(xiàn)甲基轉(zhuǎn)移酶EZH2在晶狀體中高表達,AKT-EZH22通路在TGF-β誘導的上皮-間質(zhì)轉(zhuǎn)化(EMT)中非常重要��。質(zhì)譜分析結(jié)果顯示,MYPT1/PP1能使EZH2-S21去磷酸化����。這些結(jié)果確定了EZH2-S21的特異性磷酸酶,并揭示了EZH22去磷酸化控制的�����、與晶狀體EMT和眼睛前囊下白內(nèi)障(ASC)發(fā)病相關的幾個基因家族。
主要技術:
shRNA慢病毒穩(wěn)轉(zhuǎn)株構(gòu)建����、免疫共沉淀(Co-IP)、蛋白質(zhì)譜檢測(LC-MS/MS)����、CRISPR/Cas9;
輝駿生物為本研究提供了蛋白質(zhì)譜檢測和分析服務(LC-MS/MS)����。
研究背景:
EZH2是多梳抑制復合物2(PRC2)中發(fā)揮甲基轉(zhuǎn)移酶活性的核心成員,可以催化H3K27Me3�����,進而抑制下游基因轉(zhuǎn)錄�����。此外��,EZH2還可以作為獨立于PRC2復合物的非組蛋白甲基轉(zhuǎn)移酶�����,甲基化轉(zhuǎn)錄因子和其他靶標。蛋白磷酸化在EZH2功能開關中起著重要作用����。已知AKT激酶可以介導EZH2-S21磷酸化來抑制其H3K27Me3催化功能。然而���,負責EZH2-S21去磷酸化的酶仍然未知����。
研究路線:
WB和IF檢測發(fā)現(xiàn)AGS小鼠模型和患者中的EZH2-S21磷酸化與EMT有關生長RNA干擾實驗確定AKT磷酸化EZH2-S21來介導TGF-β誘導的晶狀體上皮細胞EMTCo-IP MS和敲除實驗發(fā)現(xiàn)并證實MYPT1-PP1使EZH2-S21去磷酸化來抑制EMTEZH2-S21突變表達�、轉(zhuǎn)錄組分析和ChIP-seq確認EZH2-S21去磷酸化調(diào)控的下游基因RNA干擾和基因敲除實驗證實EZH2-S21去磷酸化通過POSTN基因促進EMT和ASC細胞、小鼠模型和患者檢測證實EZH2-S21磷酸化狀態(tài)調(diào)控了EMT相關基因表達和AGS病變
研究結(jié)果:
1. EZH2在晶狀體上皮細胞中高表達且其活性和S21磷酸化水平隨EMT而增強
為了解EZH2在晶狀體中的作用�,Western blot(WB)檢測了3周齡和成年小鼠晶狀體上皮細胞和纖維細胞中的EZH2和EZH2-S21磷酸化(p-EZH2 S21)水平,結(jié)果顯示:EZH2在3周齡和成年上皮細胞中均高表達�,p-EZH2 S21在成年上皮細胞中的水平顯著高于3周齡小鼠,EZH2和p-EZH2 S21在成年纖維細胞中幾乎檢測不到(圖1A�,B)。
正因為EZH2在小鼠晶狀體中高表達�,因此推測其可能參與ASC上皮細胞的EMT進程。對患者和小鼠模型的ASC斑塊進行IF和WB分析���,發(fā)現(xiàn)AKT活性和p-EZH2 S21水平顯著高于對照(圖1C-E)。低活性的EZH2(表現(xiàn)為較高的p-EZH2-S21和較低的H3K27me3)伴隨著為高水平的EMT標記物(FN和α-SMA)(圖1E)��。
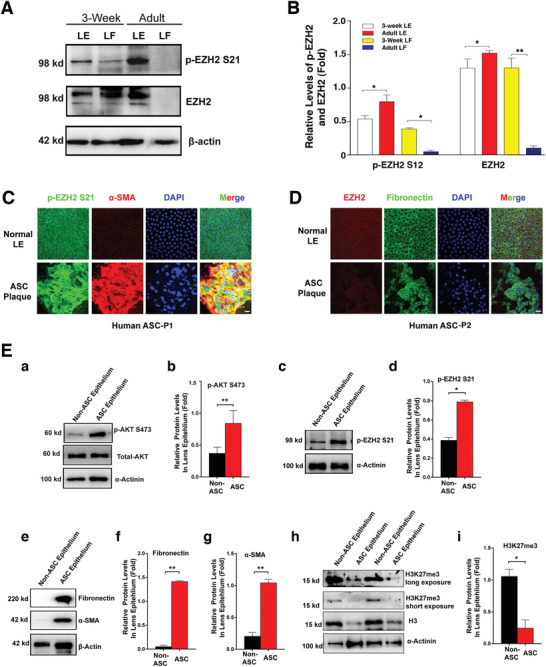
圖1
2. TGF-β激活AKT-EZH2-H3K27Me3通路來介導晶狀體上皮細胞中的EMT
為了確定AKT是否也能磷酸化EZH2-S21來調(diào)節(jié)晶狀體細胞的EMT,作者首先用TGF-β處理人晶狀體上皮細胞系HLE 48小時�����,建立了EMT模型�,接著用AKT活性抑制劑來封閉AKT的活性,這使得p-EZH2 S21減弱���,H3K27Me3增強����,并且消除了TGF-β誘導引起的EMT標記物FN1和α-SMA的水平增加����;AKT1和AKT2的敲低也得到了類似結(jié)果(圖2A-G)。這表明AKT能調(diào)控EZH2-S21磷酸化���,介導TGF-β誘導的晶狀體上皮細胞EMT�����。
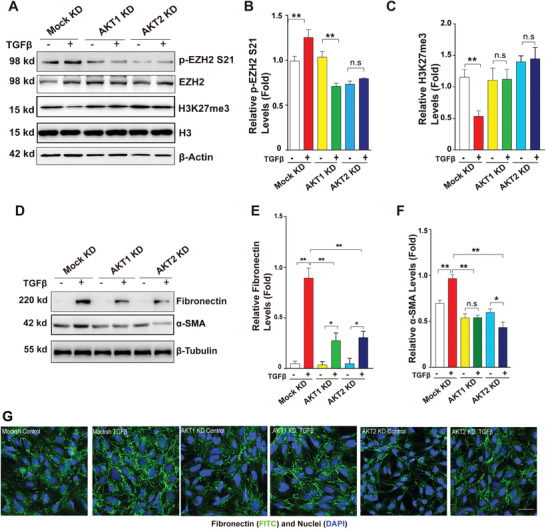
圖2
3. MYPT1-PP1使EZH2-S21去磷酸化
那么是哪個蛋白酶去磷酸化EZH2-S21呢���?作者利用OA(PP1和PP2A的有效抑制劑)處理HLE細胞���,發(fā)現(xiàn)OA劑量依賴性的增加了p-EZH2 S21水平(圖3A-B)。免疫共沉淀質(zhì)譜(Co-IP MS)分析發(fā)現(xiàn)EZH2的結(jié)合蛋白除了有PRC2的其他組分SUZ12��、EED和RBBP4之外�����,還有PP1調(diào)節(jié)亞基PPP1R12A(也稱為MYPT1)��,這引起了作者的注意�。Co-IP WB和IF實驗進一步確定了EZH2和MYPT1間的相互作用(圖3C-F)。
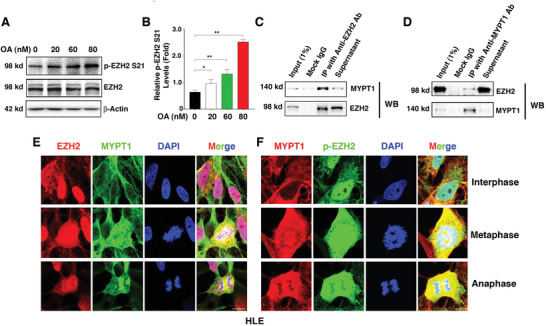
圖3
4. MYPT1敲除增強了晶狀體上皮細胞EMT
為了證實MYPT1-PP1通過去磷酸化EZH2影響晶狀體上皮細胞的EMT進程����,作者采用CRISPR/Cas9技術敲除HLE細胞中的MYPT2,發(fā)現(xiàn)p-EZH2 S21增強�,H3K27Me3水平下降(圖4A-C),并且TGF-β誘導的EMT顯著增強(圖4D-G)����。MYPT2和EZH2沉默的斑馬魚突變體也表現(xiàn)出嚴重的心臟水腫、脊柱彎曲和小眼等表型��,眼部組織中的EMT標志物(FN1a, LAMC2和MMP9)也顯著上調(diào)����。這些結(jié)果表明,MYPT1-PP1可以使EZH2去磷酸化��,激活其甲基轉(zhuǎn)移酶活性����,并在體外和體內(nèi)調(diào)節(jié)EMT。
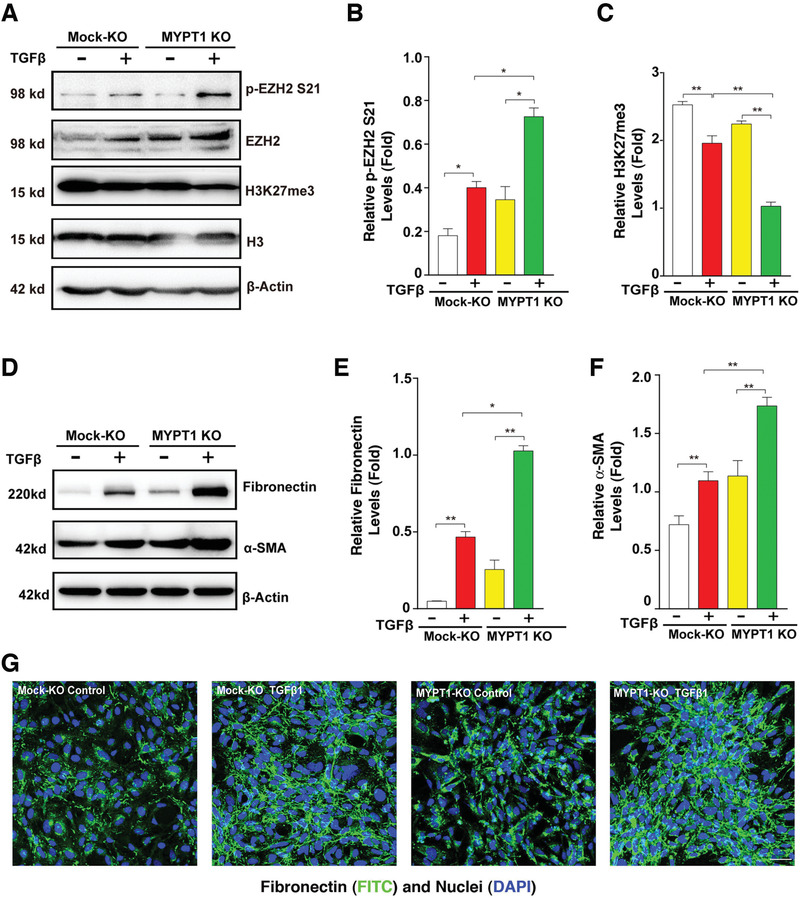
圖4
5. 內(nèi)源性EZH2-S21突變抑制了TGF-β誘導的EMT
為了進一步確定EZH2-S21磷酸化能否從功能上控制EMT進程���,作者采用EZH2野生型和EZH2-S21突變型(絲氨酸突變成賴氨酸)慢病毒分別感染HLE細胞構(gòu)建穩(wěn)轉(zhuǎn)細胞株(圖5A-C)�����,WB和IF分析證實�,相比于空載對照��,它們的表達均顯著抑制了TGF-β誘導的EMT標志物上調(diào)(圖5D-G)���。
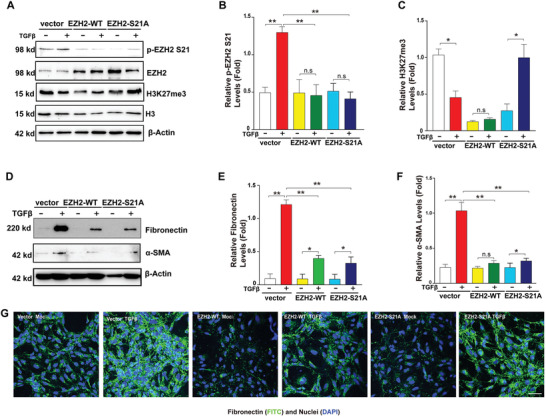
圖5
6. EZH2去磷酸化調(diào)控多個EMT相關的基因家族
為了找到EZH2去磷酸化調(diào)控的下游基因��,作者對EZH2野生型�����、EZH2-S21突變型和空載對照細胞株進行了轉(zhuǎn)錄組分析, GO分析結(jié)果顯示很多差異基因?qū)儆诩毎饣|(zhì)基因和細胞粘附基因���;之后又在敲除了內(nèi)源EZH2的細胞中再表達EZH2野生和EZH2-S21突變體����,并用TGF-β處理����。qPCR檢測了轉(zhuǎn)錄組篩選出的差異基因,確定了三個參與EMT調(diào)控的基因家族——膠原基因�����、細胞外基質(zhì)基因和細胞粘附基因(圖6A-D)����。為了進一步證實EZH2去磷酸化調(diào)控了這3個基因家族,選取了3個主要靶基因Col1A1��、MMP17和POSTN進行ChIP-seq����,發(fā)現(xiàn)TGF-β處理的HLE細胞中的H3K27me3水平遠小于未處理組(圖6E)。
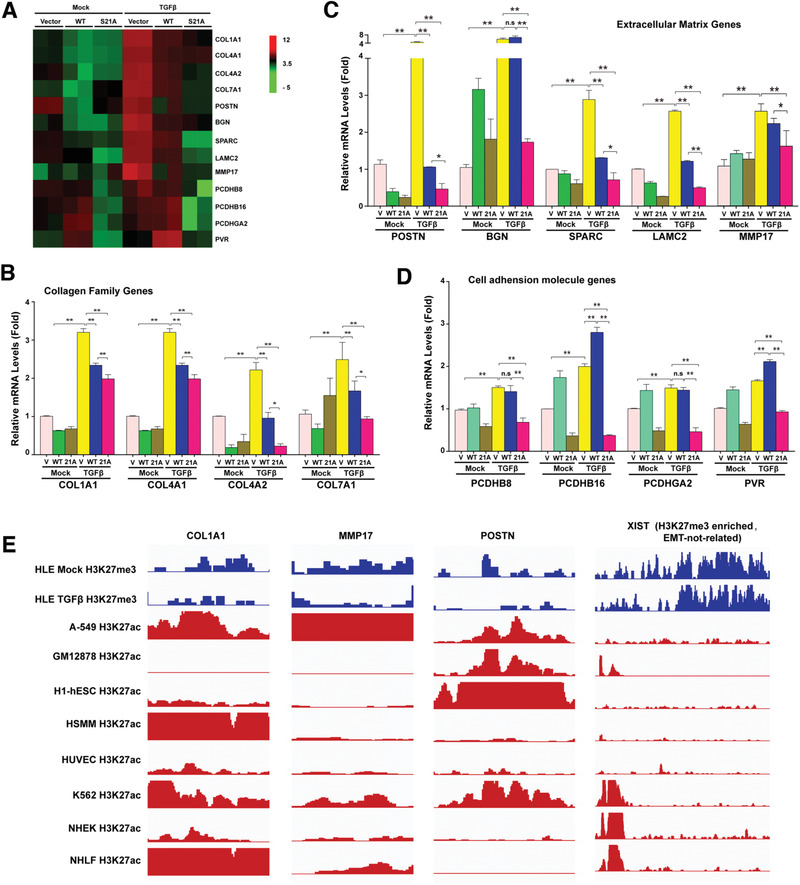
圖6
7. EZH2-S21磷酸化調(diào)控POSTN基因來促進TGF-β誘導的EMT和ASC
為了進一步確定上述EMT相關基因家族確實受EZH2-S21去磷酸化控制并參與EMT和AGS病變,研究者利用慢病毒構(gòu)建EZH2沉默的HLE細胞系�,再此基礎上分別進行EZH2過表達、EZH2-S21A過表達和EZS2-S21D過表達(圖7A-C)���。qPCR檢測發(fā)現(xiàn)POSTN在EZS2-S21D細胞中的豐度最高(圖7D)。使用CRISPR/Cas9技術(圖7E)或shRNA(圖7F)敲除MYPT1可顯著增加POSTN mRNA水平��,在MYPT1突變的斑馬魚眼睛中也觀察到POSTN的表達增強���。
在POSTN沉默細胞中���,TGF-β處理組的EMT標記物(FN、COL1A1����、SNAI1和SNAI2)水平均顯著低于非沉默細胞(圖7G-J)。在POSTN基因敲除小鼠中���,ASC的誘導受到限制����,EMT標志物(FN��、COL1A1)的表達也顯著降低(圖7K-M)。在患者ASC斑塊中���,POSTN也高表達(圖7N)���。
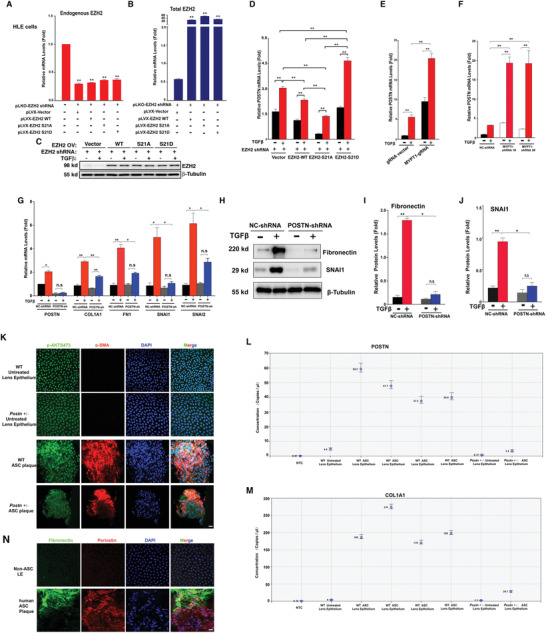
圖7
8. MYPT敲除促進了EMT相關基因表達和AGS病變
為了進一步確定EZH2-S21去磷酸化直接控制的EMT相關基因,研究者用TGF-β處理MYPT敲除細胞或未敲除細胞����,qPCR方法檢測發(fā)現(xiàn)SPARC、BGN��、PCDHB8���、PCDHB16���、COL1A1、COL4A1��、COL4B2和COL7A1的水平顯著高于對照(圖8A)�。在ASC小鼠模型(圖8B)和人類ASC患者(圖8C)中也得到了相似結(jié)果,表明這些由EZH2-S21去磷酸化控制的EMT相關基因顯著促進了ASC病變����。
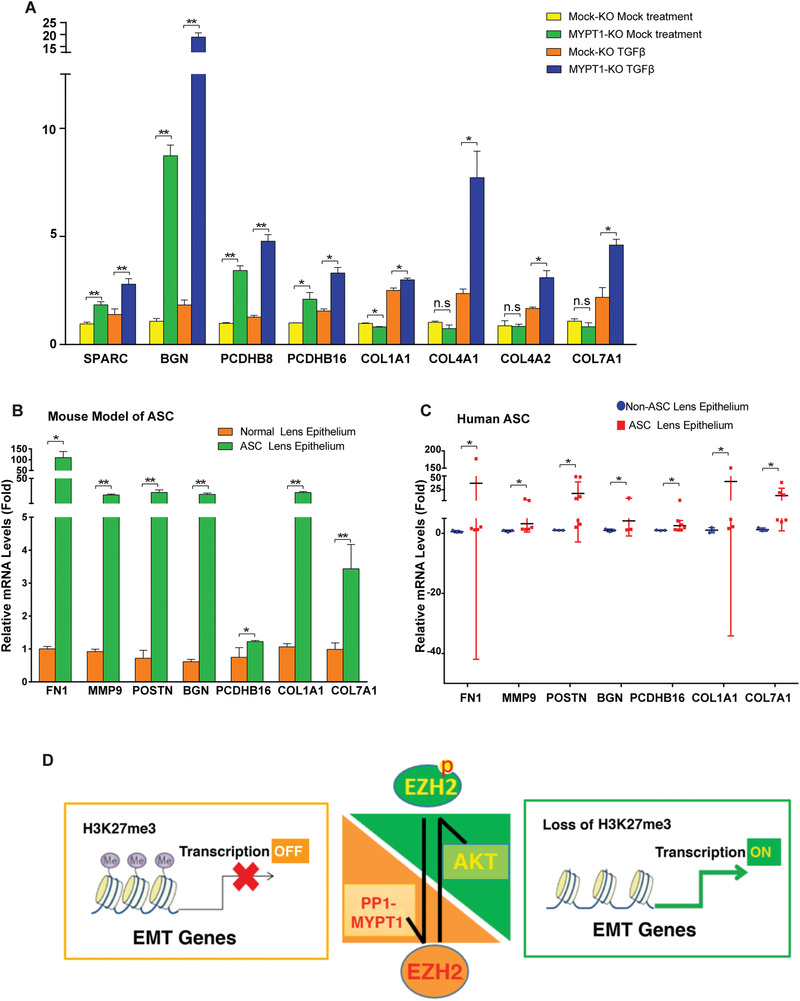
圖8
研究結(jié)論:
該研究不僅確定了AKT激活EZH2-H3K27Me3來調(diào)控TGF-β誘導的晶狀體上皮細胞EMT,而且發(fā)現(xiàn)了MYPT1-PP1可使EZH2-S21去磷酸化,進而調(diào)控3個EMT相關基因家族參與ASC病變(圖8D)��。









 實驗熱線:4006991663
實驗熱線:4006991663











